
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
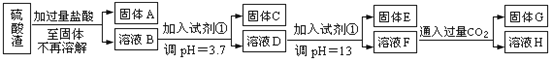
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
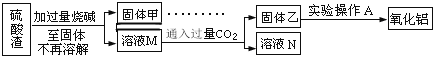
(5)此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2molL-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
【答案】
(1)Mg(OH)2:A;(2)C;
(3)NaCl、NaHCO3;(4)灼烧;(5)二氧化硅;
(6)SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(7)MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;(8)5.6%。
【解析】
试题分析:(1)根据以上分析,固体E是氢氧化镁,试剂①是强碱溶液,故答案为:Mg(OH)2:A;
(2)因pH值精确到小数点后一位,而石蕊试液测得的PH值在一个范围内,广泛pH试纸测得的pH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:C;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,所以溶液H的溶质含有NaCl 和 NaHCO3,故答案为:NaCl、NaHCO3;
(4)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(5)根据以上分析,固体乙是硅酸、氢氧化铝,进行加热得到二氧化硅和氧化铝,所以此方案制得的氧化铝含有的主要杂质是二氧化硅,故答案为:二氧化硅;
(6)向溶液M中通入过量二氧化碳气体,硅酸钠、偏铝酸钠、氢氧化钠都与二氧化碳反应,由溶液M→固体乙这个过程中,硅酸钠和过量二氧化碳反应生成硅酸沉淀和碳酸氢钠,离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(7)KMnO4在酸性条件下与Fe2+进行氧化还原反应的离子方程式为MnO4- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O,故答案为:MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O;
(8)利用关系式法计算:
5Fe2+ ~~~~~~~~MnO4-
2×10-3mol 1.000×10-2molL-1×0.01L×4
铁元素的质量为:2×10-3mol×56g/mol=1.12×10-1g,铁元素的质量分数为![]() ×100%=5.6%,故答案为:5.6%。
×100%=5.6%,故答案为:5.6%。


科目:高中化学 来源: 题型:
【题目】CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
(1)【提出假设】假设1:沉淀为Cu(OH)2
假设2:沉淀为______________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;

(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设___________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_________(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)B装置使用改进后的试剂,乙同学验证假设3成立的实验现象是A中__________________,B中__________________,C中_________________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是___________(填代号)

A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
E.②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中产生的沉淀的质量为39.4g,A中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 _______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是______________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:__________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确 。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的,设计实验证明烧瓶内溶液中含H2O2,简述实验方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH 的Ba(OH)2、KOH 和NH3.H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某同学对KHSO4的物质类型进行的分析,其中不正确的是( )
A.根据元素组成知它是化合物
B.因它含有钾离子与酸根离子,故KHSO4是钾盐
C.KHSO4可以称为硫酸氢盐
D.因为它含有与酸相同的元素氢,故KHSO4也可称为酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) == C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是__________反应(填“吸热”或“放热”)。
(2)E1表示 ,E2表示 ,ΔH=________。
(3)反应体系中加入催化剂对反应热是否有影响? (填“有影响”“无影响”),原因是 。
(4)在反应体系中加入催化剂,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验装置图、实验操作及结论描述正确的是

A.打开弹簧夹,由漏斗中加水至产生液面差,液面高度差不变时,说明装置气密性良好
B.打开弹簧夹一段时间后,红墨水倒吸入导气管中,说明铁钉发生了析氢腐蚀
C.滴入浓硫酸后一段时间,高锰酸钾溶液褪色,说明产生了还原性气体
D.加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“信息”“材料”和“能源”被称为新科技革命的三大支柱。下列有关信息错误的是
A. 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B. 目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C. 载人飞船使用了大量的复合材料
D. 合成高分子材料的广泛应用是有百利而无一害的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com