
【题目】有等体积、等pH 的Ba(OH)2、KOH 和NH3.H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含电子数与 个H2O分子中所含电子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是 mol。
(3)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 。
(4)标准状况下,①4 g氢气、②33.6 L甲烷(CH4)、③6.02×1023个水分子中,含原子数最多的是_________(填序号)。
(5)在标准状况下,将224L HCl气体溶于635mL(ρ=1.00gcm-3)的水中,所得盐酸的密度为1.20gcm-3。求该盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H++2e-→H2 B.Fe2++2e-→Fe
C.2H2O+O2+4e-→4OH- D.Fe3++e- →Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某短周期元素X,其原子的电子层数为n,最外层电子数为2n+1。下列有关元素X的说法错误的是
A. 元素X不可能是金属元素
B. 元素X的气态氢化物不一定是电解质
C. 元素X —定能形成化学式为KXO3的含氧酸钾盐
D. 工业上制取X的单质时一定采用氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验:
装 置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法正确的是
A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B.铁片Ⅳ的电极反应式可能为Fe-3e-=Fe3+
C.用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极
D.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%.目前我国已经在技术上取得突破--用硫酸渣炼铁.Fe3+开始沉淀为氢氧化物的PH=1,沉淀完全时的PH为3.7.
I.某探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:
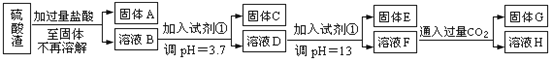
请回答:
(1)写出固体E的化学式:______________.试剂①是__________(填选项字母).
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是__________(填选项字母).
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:______________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________________.
方案二:
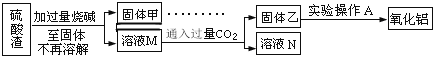
(5)此方案制得的氧化铝含有的主要杂质是_________________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:_______________;_______________。
(7)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:_______________。
(8)某同学称取2.000g硫酸渣,预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2molL-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液10.00mL,则残留物中铁元素的质量分数是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A. 阴极 B. 阳极 C. 正极 D. 负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com