
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________。
(2)工作时,正极反应为______________________________。
(3)工作时,电解质溶液的酸性__________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向____________极。
(5)电流方向从____________极流向____________极。
科目:高中化学 来源: 题型:
【题目】某200 mL氯化镁和氯化铝混合液中c(Mg2+)为0.3 mol/L,c(Cl-)为1.2 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol/L NaOH溶液的体积为
A.70 mL B.60mL C.80 mL D.128 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.4 mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表:
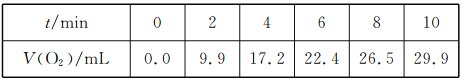
下列叙述错误的是(溶液体积变化忽略不计)( )
A.反应至6 min时,c(H2O2)=0.20mol/L
B.反应至6 min时,H2O2分解了40%
C.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol.L-1.min-l
D.6~10 min的平均反应速率:可(H2O2) <3.3×10-2 mol.L-1.min-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Zn+2FeCl3===ZnCl2+2FeCl2设计一个原电池。
(1)在下图方格内画出实验装置图,
(2)指出正极材料为__________,电极反应式为______________________;
负极材料为____________,电极反应类型为_________________________。
(3)外电路中的电子是从____________极流向__________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5体积某气态烃只能与0.5体积氯气发生加成反应,生成氯代烷,0.5 mol此氯代烷可与3 mol氯气发生完全的取代反应,则该烃的结构简式为( )
A.CH2=CH2 B.CH3CH=CH2 C.CH3CH3 D.CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是

A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO ![]() CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1)原混合气体的物质的量是 ;生成沉淀的摩尔质量是 。
(2)原混合气体中甲烷的体积是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
(1)【提出假设】假设1:沉淀为Cu(OH)2
假设2:沉淀为______________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;

(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设___________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_________(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)B装置使用改进后的试剂,乙同学验证假设3成立的实验现象是A中__________________,B中__________________,C中_________________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是___________(填代号)

A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
E.②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中产生的沉淀的质量为39.4g,A中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色。

请问答下列问题:
(1)反应①-⑤中,既属于氧化还原反应又属于化合反应的是______________(填序号)。
(2)反应⑤的化学方程式为____________________________。
(3)甲与B反应的离子方程式 _______________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是______________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为:__________________。
(6)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色。向3.9g A和50g B混合后的溶液中滴入2滴酚酞试液,溶液变红色,片刻红色褪去(假设过程中液体体积不变)。
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,上述观点是否正确 。
②乙同学认为“红色迅速褪去”是由于A + B = 碱 + H2O2 ,H2O2具有氧化性和漂白性导致的,设计实验证明烧瓶内溶液中含H2O2,简述实验方法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com