


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 |
| H-H | 436 | H-N | 391 | F-F | 158 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“摩尔”是某基本物理量的基本单位 |
| B、1mol水中含有2mol氢和1mol氧 |
| C、NaOH 的摩尔质量是40 g |
| D、0.012kg C-14中含有阿伏伽德罗常数个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸和食醋既是化合物又是酸 |
| B、凡是生成两种或两种以上物质的反应都是分解反应 |
| C、氯化钠和HCl溶于水都发生电离,克服粒子间作用力相同 |
| D、一种元素可能有多种氧化物,且一种化合价可能对应不止一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③⑤⑦ |
| C、④⑧ | D、②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
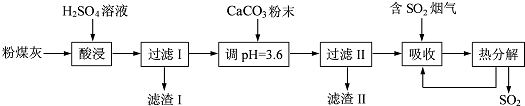
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com