
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol/L,c(HI)=3 mol/L,则此温度下反应①的平衡常数为
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol/L,c(HI)=3 mol/L,则此温度下反应①的平衡常数为
A.9 B.16 C.12 D.25
科目:高中化学 来源: 题型:
【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O(g)![]() 2H2+O2
2H2+O2
c.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O(g)![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
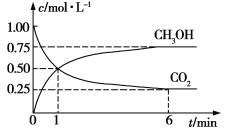
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的铯(133Cs)原子钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒.已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为
A. 133 B. 78 C. 55 D. 23
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。
(1)以下是实验室常用的部分仪器。

①仪器f和j的名称分别为_____、______。
②在分液操作中,必须用到的仪器是_________(填字母,下同)。
③能作反应容器且可直接加热的仪器是_________。
④过滤时,需要用到的玻璃仪器是_________
(2)下列实验操作的叙述中,正确的是______(填字母)。
A.将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.稀释浓硫酸时,可先在烧杯中加入一定体积的浓硫酸,再在搅拌下慢慢加入水
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
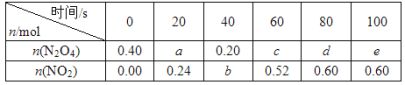
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
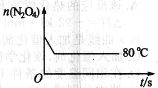
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。

②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。

①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂已略去)

已知: ①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②![]()
③![]()
请回答下列问题:
(1)B的化学名称为______________。A中官能团的电子式为________________。
(2)C中共面的原子最多有________个。I的结构简式为_____________________。
(3)F→G的化学方程式为________________________________________________。
(4)M不可能发生的反应为_______________(填选项字母)
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(5)同时满足下列条件的E的同分异构体有_________种。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有—个—NH2
(6)参照上述合成路线,以 ![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com