
����Ŀ��CO��H2����Ϊ�ϳ������úϳ������Ժϳ����ᡣ�ش��������⣺
(1)��֪CO��H2��CH3COOH��ȼ������H�ֱ�Ϊ-283.0kJ/mol��-285.8kJ/mol��-1255.0kJ/mol�����úϳ����ϳ�CH3COOH(l)�Ŀ�����̵��Ȼ�ѧ��Ӧ����ʽΪ___________________________________________��
(2)���ܱ������з����ϳ�����ķ�Ӧ�����п������CH3COOH���ʵĴ�ʩ��________��
A�����º��ݣ�ͨ���������� B.��ʱ�������������
C�������Ч���� D��ѹ���������
(3)��150��ʱ��2L���ܱ������з�����Ӧ��
2H2(g)+2CO(g)![]() CH3COOH(g) ��H>0����ʼͨ��4molH2��4molCO��CH3COOH������Ũ��������ʱ��仯���±���ʾ��
CH3COOH(g) ��H>0����ʼͨ��4molH2��4molCO��CH3COOH������Ũ��������ʱ��仯���±���ʾ��
ʱ��/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
��0~2min����CO��ʾ�÷�Ӧ������Ϊ_________________�����ŷ�Ӧ�Ľ������������Ŀ���ԭ����____________________________________________________��
��150��ʱ�÷�Ӧ��ƽ�ⳣ������ֵԼΪ_________��������������һλС����
��ƽ�����ͨ��1molH2����CH3COOH(g)���������________�����ٴ�ͨ��1molH2��1molCO����CH3COOH(g)���������_________�����������С�����ߡ����䡱��
(4)һ���¶��£��ݻ���Ϊ1L�������ܱ�����֮�н�������ʵ�飺
ʵ���� | ��ʼͶ�� |
�� | 2molH2��2molCO |
�� | 1molCH3COOH(g) |
��ʵ�����H2��ʵ�����CH3COOH��ת������ʱ��仯ͼʾ���£�
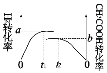
��a+b=_______���ﵽƽ���ʱ���С��ϵΪt1__________t2�����>����<������ȷ������
���𰸡�2H2(g)+2CO(g)![]() CH3COOH(l) ��H=+117.4kJ/mol BD 0.3mol/(L��min) ���ŷ�Ӧ�Ľ��з�Ӧ��Ũ�Ƚ��� 1.5 ��С ���� 100% ��ȷ��
CH3COOH(l) ��H=+117.4kJ/mol BD 0.3mol/(L��min) ���ŷ�Ӧ�Ľ��з�Ӧ��Ũ�Ƚ��� 1.5 ��С ���� 100% ��ȷ��
��������
��1����д��ȼ���ȵ��Ȼ�ѧ����ʽ��Ȼ����ݸ�˹���ɽ��м��㣻
��2���������������ƽ���ƶ��Ĺ��ɽ��з�����
��3���ٸ���v=![]() ���м��㣻
���м��㣻
�ڸ���ƽ�ⳣ��![]() ���м��㣻
���м��㣻
��ֻ����һ�ַ�Ӧ�ƽ�������ƶ���n(CH3COOH)���������С��n(��)��������ȣ���![]() ��С��H2��COͬ�ȳ̶ȵ�����Ũ�ȣ��൱�ڼ�ѹ����ƽ�������ƶ���
��С��H2��COͬ�ȳ̶ȵ�����Ũ�ȣ��൱�ڼ�ѹ����ƽ�������ƶ���
��4��һ���¶��£��ݻ�Ϊ1L�������ܱ�����֮�зֱ�ͨ��2molH2��2molCO��1molCH3COOH(g)���ֱ����������������ƽ�⣬���ն��ߴﵽ��Чƽ��״̬��������������ķ�Ӧ��ת����֮��Ϊ100%������������Ӧ�ֱ����������ʼ����Ӧ��Ũ�Ȳ�ͬ����ϵѹǿҲ��ͬ��������϶࣬�ݴ˷�����
��1�����ݷ�Ӧ����Ϣ�ã�
��2CO(g)+O2(g)=2CO2(g) ��H=��283.0��2kJ/mol��
��2H2(g)+O2(g)=2H2O(g) ��H=��285.8��2kJ/mol��
��CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ��H=��1255.0kJ/mol��
��ʽ+��ʽ����ʽ���ɵ�Ŀ�귽��ʽ��
2H2(g)+2CO(g)![]() CH3COOH(l) ��H=+117.4kJ/mol��
CH3COOH(l) ��H=+117.4kJ/mol��
�ʴ�Ϊ��2H2(g)+2CO(g)![]() CH3COOH(l) ��H=+117.4kJ/mol��
CH3COOH(l) ��H=+117.4kJ/mol��
��2��A�����º���ͨ��������壬��Ӱ������Ҳ��Ӱ��ƽ�⣬A����
B����ʱ������������ᣬ���Խ����������Ũ�ȣ�ʹƽ�������ƶ���CH3COOH�IJ�������B��ȷ��
C����Ӵ���ֻӰ�����ʲ�Ӱ��ƽ�⣬C����
D��ѹ�������ƽ���������������С�����ƶ���CH3COOH�IJ�������D��ȷ��
��ѡBD��
��3����0~2min����CO��ʾ��Ӧ����=![]() �����ŷ�Ӧ�Ľ��з�Ӧ��Ũ�ȼ�С��������С��
�����ŷ�Ӧ�Ľ��з�Ӧ��Ũ�ȼ�С��������С��
�ڻ�ѧƽ�ⳣ����ƽ��ʱ������Ũ���ݵij˻��뷴Ӧ��Ũ���ݵij˻��ı�ֵ���ʴ��¶���ƽ�ⳣ��![]() ��
��
��ֻ����һ�ַ�Ӧ�ƽ�������ƶ���n(CH3COOH)���������С��n(��)��������ȣ���![]() ��С��H2��COͬ�ȳ̶ȵ�����Ũ�ȣ��൱�ڼ�ѹ����ƽ�������ƶ�����CH3COOH�����������
��С��H2��COͬ�ȳ̶ȵ�����Ũ�ȣ��൱�ڼ�ѹ����ƽ�������ƶ�����CH3COOH�����������
�ʴ�Ϊ��0.3mol/(L��min)�����ŷ�Ӧ�Ľ��з�Ӧ��Ũ�Ƚ��� ��1.5����С ������
��4��һ���¶��£��ݻ�Ϊ1L�������ܱ�����֮�зֱ�ͨ��2molH2��2molCO��1molCH3COOH(g)���ֱ����������������ƽ�⣬���ն��ߴﵽ��Чƽ��״̬��������������ķ�Ӧ��ת����֮��Ϊ100%������������Ӧ�ֱ����������ʼ����Ӧ��Ũ�Ȳ�ͬ����ϵѹǿҲ��ͬ��������϶࣬�ʷ�Ӧ���ʲ�֪�ĸ���Ӧ�죬�ʴﵽƽ���ʱ�䲻ȷ����
�ʴ�Ϊ��100% ����ȷ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ķ���ʽΪC2H4����һ����Ҫ�Ļ���ԭ�Ϻ������Դ���о���ϩ���Ʊ����ۺ����þ�����Ҫ���塣
��ش��������⣺
��1����ϩ���Ʊ�����ҵ�ϳ����÷�ӦC2H6��g��![]() C2H4��g��+H2��g�� ��H�Ʊ���ϩ��
C2H4��g��+H2��g�� ��H�Ʊ���ϩ��
��֪����C2H4��g��+3O2��g��=2CO2��g��+2H2O��l�� ��H1=-1556.8kJ��mol-1��
��H2��g��+![]() O2��g��=H2O��1�� ��H2=-285.5kJ��mol-1��
O2��g��=H2O��1�� ��H2=-285.5kJ��mol-1��
��C2H6��g��+![]() O2��g��=2CO2��g��+3H2O��l�� ��H3=-1559.9kJ��mol-1��
O2��g��=2CO2��g��+3H2O��l�� ��H3=-1559.9kJ��mol-1��
���H=___kJ��mol-1��
��2����ϩ�������Ʊ��Ҵ���C2H4��g��+H2O��g��![]() C2H5OH��g������ij�����ܱ������г���a mol C2H4��g���� a mol H2O��g�������C2H4��g����ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
C2H5OH��g������ij�����ܱ������г���a mol C2H4��g���� a mol H2O��g�������C2H4��g����ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
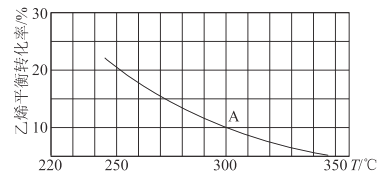
�ٸ÷�ӦΪ____�ȷ�Ӧ��������š���������Ϊ____��
��A��ʱ����������������ʵ���Ϊ____����֪��ѹ=��ѹ���������ʵ����������������ѹ���Ũ�ȼ����ƽ�ⳣ����ѹǿƽ�ⳣ����KP�������300��ʱ����Ӧ�ﵽƽ��ʱ�������ڵ�ѹǿΪb MPa����A���Ӧ�¶��µ�KP=____MPa-1���ú�b�ķ�����ʾ����
����֪��C2H4��g��+H2O��g��![]() C2H5OH��g���ķ�Ӧ���ʱ���ʽΪv��=k��c��C2H4����c��H2O����v��=k��c��C2H5OH�������У�k����k��Ϊ���ʳ�����ֻ���¶��йء������¶ȴ�250�����ߵ�340��Ĺ����У������ƶϺ�������___����ѡ����ĸ����
C2H5OH��g���ķ�Ӧ���ʱ���ʽΪv��=k��c��C2H4����c��H2O����v��=k��c��C2H5OH�������У�k����k��Ϊ���ʳ�����ֻ���¶��йء������¶ȴ�250�����ߵ�340��Ĺ����У������ƶϺ�������___����ѡ����ĸ����
A��k������k����С B��k����С��k������
C��k������ı�������k�� D��k������ı���С��k��
�������������������䣬��������Ϊ��ѹ�ܱ���������300��ʱ��C2H4��g����ƽ��ת����__10%���>����<����=������
��3����ϩ���Ա�����Ϊ��ȩ��CH3CHO���������ȩ������ˮ��Һ�����Ʊ����Ҵ������ᣬ����������ĵ缫Ϊ_____���������������������Ӧ�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������������ᣨ�ף� Ka=1.8��10-5����һ�����ᣨ�ң� Ka=1.4��10-3����ˮ�еĵ������Ũ�ȹ�ϵ���ǣ���

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵʩ����ɽ��ˮ�������������о���������������
��1��H2�ڴ��������¿ɽ�NO��ԭΪN2����ͼ�Ǹ÷�Ӧ����1 molˮ�����������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ__________��

��2��2NO(g)��O2(g)![]() 2NO2(g)�ķ�Ӧ�������£�
2NO2(g)�ķ�Ӧ�������£�
��Ӧ��2NO(g)![]() N2O2(g)(��) ��H1��0��v1����k1����c2(NO)��v1����k1����c(N2O2)��
N2O2(g)(��) ��H1��0��v1����k1����c2(NO)��v1����k1����c(N2O2)��
��Ӧ��N2O2(g)��O2(g)![]() 2NO2(g����������H2��0��v2����k2����c(N2O2)��c(O2)��v2����k2����c2(NO2)��
2NO2(g����������H2��0��v2����k2����c(N2O2)��c(O2)��v2����k2����c2(NO2)��
��һ�������£���Ӧ2NO(g)��O2(g)![]() 2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��K��___________���ú�k1����k1����k2����k2���Ĵ���ʽ��ʾ������Ӧ��Ļ��E��___________������>����<��������������Ӧ��Ļ��E����
2NO2(g)�ﵽƽ��״̬��ƽ�ⳣ��K��___________���ú�k1����k1����k2����k2���Ĵ���ʽ��ʾ������Ӧ��Ļ��E��___________������>����<��������������Ӧ��Ļ��E����
����֪��Ӧ���ʳ���k���¶����߶������������¶Ⱥ�k2������ı���__________��������������С����������������k2������ı�����
��3���ҹ���ѧ������Ȼ�������о�����ȡ�����½�չ��������ͼװ�ÿɷ�����Ӧ��H2S��O2=H2O2��S����
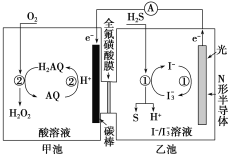
��װ����H����_______��Ǩ�ơ�
���ҳ���Һ�з�����Ӧ�����ӷ���ʽ��_______��
��4����ˮ����ʱ��ͨH2S(���S2��)��ʹijЩ�����������ɼ����ܵ��������ȥ��25 �棬ij��Һ��c(Mn2��)��0.02 mol��L��1�����ڷ�Һ��pHʹMn2����ʼ����ΪMnSʱ����Һ��c(H2S)��0.1 mol��L��1����ʱpHԼΪ_______����֪��Ksp��MnS����5.0��10��14��H2S�ĵ��볣����Ka1��1.5��10��7��Ka2��6.0��10��15��lg 6��0.8����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ҵ�ȼ�ϵ����Ϊ��Դ���KI��Һ��װ������ͼ��ʾ������˵����ȷ���ǣ� ��
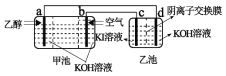
A.�׳���OH-����b�����ҳ���OH-����c��
B.a���ĵ缫��Ӧ����Ϊ��CH3CH2OH-12e-+3H2O=2CO2+12H+
C.��֪I2����OH-����IO-�������ҳص��Ҳ�����IO-
D.���ҳز���2mol����ʱ������·��ת��2mole-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪t ��ʱAgCl��Ksp��4��10��10����t ��ʱ��Ag2CrO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵���������(����)
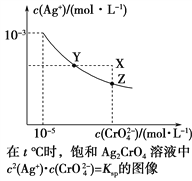
A. ��t ��ʱ��Ag2CrO4��KspΪ1��10��11
B. �ڱ�����Һ�м���K2CrO4(s)��ʹ��Һ��Y�㵽Z��
C. ��t ����Ag2CrO4(s)��2Cl��(aq) ![]() 2AgCl(s)��CrO
2AgCl(s)��CrO![]() (aq)ƽ�ⳣ��K��6.25��107
(aq)ƽ�ⳣ��K��6.25��107
D. ��t ��ʱ����0.001 mol��L��1 AgNO3��Һ�ζ�20 mL 0.001 mol��L��1 KCl��0.001 mol��L��1��K2CrO4�Ļ����Һ��CrO![]() �ȳ���
�ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
(1)Ũ��Ϊ0.1mol/L��������Һ�������غ����ʽΪ___________��
(2)��Ũ�ȵ�NaHCO3��Na2CO3�����Һ�е������غ����ʽΪ____________��
(3) Ũ��Ϊ0.1mol/LNa2CO3��Һ����غ����ʽΪ__________��
(4) ��ĭ��������ʱ������Ӧ�����ӷ�����______________��
(5)�����£�NaHSO3��Һ������Ũ���ɴ�С��˳��_________��
(6)��pH��8��Ba(OH)2��Һ��pH��5��ϡ�����ϣ���������100 ��ĺ��¡���ʹ�����Һ��pH��7����Ba(OH)2��Һ������������Ϊ________��(��֪100�棬KW=1.0��10-12)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(�� ��)
A.����ʱ��ij��Һ����ˮ���������c(H��)��c(OH��)�ij˻�Ϊ1��10��24������Һ��һ�����Դ�������K����Na����AlO2-��SO42-
B.����c(H��)�͵����������ʹ����У��ֱ��������ͬ��пƬ����ͬ״���£�����ᷴӦ�����������������
C.��֪H2CO3 �� Ka1= 4.30��10-7��Ka2= 5.61��10-11��HClO�� Ka = 3.0��10-8����ӦCO2+H2O+2NaClO=Na2CO3+2HClO�ܹ�����
D.��c(H��)������ʹ��ᣬ��ˮϡ��100����c(H��)ǰ�ߴ��ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����ʱ��Ka=1��10-5Ũ��Ϊ0.1mol/L��HA��Һ��pH=3
B.��pH=2��HCl��Һ��pH=4��H2SO4��Һ�������ϣ�������ҺpH=3
C.0.1 mol/L��ˮ��0.1 mol/L NH4Cl��Һ�������Ϻ�������ҺpH>7����c(NH4��) < c(NH3��H2O)
D.��0.1 mol/L��pH=1��NaHA��Һ�м���NaOH��Һ��Ӧ�����ӷ���ʽΪ��HA��+ OH�� = H2O + A2-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com