
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)____(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+)。
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示。

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度 变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______。(写出具体数值)
(4)室温时,向100mL 0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________。
【答案】Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 小于 I NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 (10-3 -10-11 )mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 小于 I NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 (10-3 -10-11 )mol·L-1 a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
根据盐类的水解规律及离子反应方程式的书写规则分析解答;
(1) Al3+水解生成的Al(OH)3胶体,具有吸附性,离子方程式:Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
故答案为:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2) NH4Al(SO4)2的电离方程式为NH4Al(SO4)2=NH4++Al3++2SO42-,NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-,在两溶液中NH4+发生水解,H+抑制NH4+的水解,由于NH4HSO4溶液中c(H+)远大于NH4Al(SO4)2溶液中c(H+),所以0.1mol/LNH4Al(SO4)2溶液中c(NH4+)<0.1mol/LNH4HSO4溶液中c(NH4+);
故答案为:小于;
(3) ①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;
故答案为:Ⅰ;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 molL-1-10-11mol/L;
故答案为:(10-3 -10-11 )mol·L-1;
(4) a、b、c、d四个点,根据反应化学计量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3·H2O,(NH4)2SO4可以促进水的电离,而NH3·H2O抑制水的电离,所以a点水的电离程度最大;b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3·H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
故答案为:a,c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。


科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
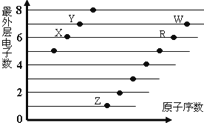
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:___。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有___(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 ___。
(2)PO43- 的空间构型是____。
(3)与NH3互为等电子体的分子、离子有___、 __(各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为___。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4] 2-,则1molCN-中含有的π键的数目为____。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如右图所示。则该化合物的化学式为____。
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)X的化学名称为__________。
(2)B单质的结构式为__________;E的气态氢化物的电子式为__________;C与D形成的两种化合物中,其中一种物质含有两种类型的化学键,分别为______________,该物质属于______________(填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是__________(写化学式)。
(4)D是同周期简单阳离子中离子半径最__________(填“大”或“小”)的元素。
(5)F的单质在反应中常作________剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
 +(2n-1)HI
+(2n-1)HI
A. 合成PPV的反应为加聚反应
B. 1molPPV最多能与4 molH2发生加成反应
C.  与溴水加成后的产物最多有14个原子共平面
与溴水加成后的产物最多有14个原子共平面
D.  和苯乙烯互为同系物
和苯乙烯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种解毒镇痛药。烃A是一种有机化工原料,下图是以它为初始原料设计合成阿司匹林关系图:

已知:(苯胺,苯胺易被氧化)
回答下列问题:
(1)C的结构简式为___________。
(2)反应⑤的反应类型___________,在③之前设计②这一步的目的是___________。
(3)F 中含氧官能团的名称________。
(4)G(阿司匹林)与足量NaOH溶液反应的化学方程式为______________。
(5)符合下列条件的 E 的同分异构体有________种。写出核磁共振氢谱中有五组峰,峰面积之比为 1:2:2:2:1 的结构简式:_______(只写一种)。
a.含—OH b.能发生水解反应 c.能发生银镜反应
(6)利用甲苯为原料,结合以上合成路线和下面所给信息合成下图所示的功能高分子材料(无机试剂任选)。________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com