
(14分)【化学——选修:化学反应原理;必做题】
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1。
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=______________kJ·mol-1
(2)将0.20 molNO和0.10 molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①0-9min内的平均反应速率v(N2)=_____mol· L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为______________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为__________(保留三位有效数字),化学平衡常数K=___________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=____________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2.已知常温下0.1 mol·L-1的HCOONa溶液pH=10,则HCOOH的电离常数Ka=___________。
(每空2分,共14分)(1)-746.5 (2)①2.2×10-3 D ②22.2% 3.4
(3)2c(SO32—)+c(HSO3—)(4)1.0×10-7
【解析】C(s)+O2(g)=CO2(g)△H1=—393.5kJ/mol,
试题分析:(1)已知:①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol,CO的燃烧热为-283kJ·mol-1,即②2CO(g)+O2(g)=2CO2(g)△H1=—566kJ/mol,则根据盖斯定律可知②—①即可得到2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=-746.5kJ·mol-1。
(2)①根据图像可知0-9min内生成氮气的浓度是0.02mol/L,则平均反应速率v(N2)=0.02mol/L÷9min=2.2×10-3mol· L-1·min-1;第12 min时CO和NO的浓度逐渐减小,而氮气的浓度逐渐增大,这说明平衡向正反应方向进行。正方应是体积减小的、放热的可逆反应,则改变的反应条件可能为降低温度,升高温度平衡向逆反应方向进行,加入NO,NO的浓度增大,加催化剂不能影响平衡, 答案选D。
②在第24 min时达到平衡状态,此时CO、NO和氮气的浓度分别是0.04mol/L、0.14mol/L、0.03mol/L,根据方程式可知生成CO2的浓度是氮气的2倍,即为0.06mol/L,因此CO2的体积分数为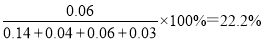 ;化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则化学平衡常数K=
;化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则化学平衡常数K= 。
。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,则根据电荷守恒2c(SO32—)+c(HSO3—)+c(OH—)=c(H+)+c(Na+)。所得溶液呈中性,则c(OH—)=c(H+),因此该溶液中c(Na+)=2c(SO32—)+c(HSO3—)。
(4)已知常温下0.1 mol·L-1的HCOONa溶液pH=10,即c(OH—)=10—4mol/L,c(H+)=10—10mol/L,根据水解方程式可知c(HCOOH)=10—4mol/L,又因为c(HCOO—)=0.1mol/L,则HCOOH的电离常数Ka=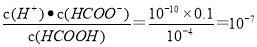 。
。
考点:考查盖斯定律的应用、平衡状态计算、外界条件对平衡状态的影响以及溶液中离子浓度大小比较和平衡常数计算等


科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

A. 通过加水稀释可以使溶液由b点变到a点
B. 加入适量BaCl2(固体) 可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列关于各实验装置与对应现象或结论的叙述均正确的是

A.图1装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.图2装置:可用于吸收NH3或HCl气体,并防止倒吸
C.图3装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3
D.图4装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
[化学——选修3物质结构与性质](15分)
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:
2Al(OH)3 + 12HF+ 3A = 2Na3AlF6 + 3CO2↑+ 9H2O
(1)熔融晶体A时需要破坏的作用力是 ,冰晶石中的配位体是 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为 ,该分子的空间构型为 。
(3)反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小 ,写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种) 、 。
(4)某种A1-Fe合金的晶胞如图所示,该合金的化学式为 。

若晶胞的边长为a nm,则合金的密度为 g cm-3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:选择题
某澄清透明溶液中只可能含有①Al3+,②Mg2+,③Fe3+,④Fe2+,⑤H+,⑥CO32-, ⑦NO3- 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是

A.②⑤⑥⑦ B.②③⑤⑦
C.①②③⑥⑦ D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中 ①一定含有I-,不能确定是否有Cl- ②一定含有NO3- ③不含有Fe3+ ④一定含有I-、NO3-和Cl-
A.① B.②③ C.④ D.①③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
【化学——选修3物质结构与性质】(15分)已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型
有____ (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:
2K2FeO4+16HCl=4KCl+2FeCl3+8H2O+3Q↑,下列说法正确的是
A.可用湿润的淀粉碘化钾试纸检验产物Q
B.K2FeO4在水中的电离方程式为K2FeO4=2K++Fe6++4O2一
C.反应中氧化剂与还原剂的物质的量之比为1:8
D.反应中涉及的6种物质均为电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24 L SO3含有分子的数目为0.1NA
B.1 mol O2与Na完全反应,转移电子数一定为4NA
C.常温常压下,1.6 g CH4中含有共价键的数目为0.4NA
D.将2 mL 0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目为0.001NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com