
【题目】某研究小组按下列路线合成肾上腺激素:

已知:
请回答:
(1)写出②过程的化学反应方程式______________。
(2)写出③过程的反应类型_____________。
(3)下列说法不正确的是________________。
A.化合物A的官能团是氯离子 B.化合物B可发生消去反应
C.化合物C不能与氯化铁反应呈紫色 D. D的分子式是C9H11NO3
(4)设计以环己烷为原料制备的![]() 合成路线(用流程图表示,无机试剂任选)_____________。
合成路线(用流程图表示,无机试剂任选)_____________。
(5)写出同时符合下列条件的D的所有同分异构体的结构简式________________。
①分子中有硝基:
②1H-NMR谱表明分子中有3种氢原子;IR谱显示存在苯环。
【答案】 
![]()
![]()
![]()

![]()
 消去反应(或氧化反应) AB
消去反应(或氧化反应) AB ![]()

【解析】根据流程信息及已知 ,可推出由乙酸酐
,可推出由乙酸酐 与氯气在一定条件下发生取代反应生成A,A为
与氯气在一定条件下发生取代反应生成A,A为 ,
, 与乙酸发生取代反应生成乙酸酐和B,B为
与乙酸发生取代反应生成乙酸酐和B,B为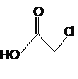 ,
,![]() 发生消去反应生成C,C为
发生消去反应生成C,C为![]() ,B与C在POCl3催化下反应生成
,B与C在POCl3催化下反应生成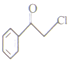 ,
, 与CH3NH2反应生成D,D为
与CH3NH2反应生成D,D为 ,
, 催化加氢得
催化加氢得 。故(1)②过程为
。故(1)②过程为 与乙酸发生取代反应生成乙酸酐和B,化学反应方程式为:(1).
与乙酸发生取代反应生成乙酸酐和B,化学反应方程式为:(1). 
![]() CH3COOH
CH3COOH![]()
 +
+ ;(2)③过程为
;(2)③过程为![]() 发生消去反应生成
发生消去反应生成![]() ;(3) A.化合物
;(3) A.化合物 的官能团是酰氯和酸酐,选项A不正确; B.化合物
的官能团是酰氯和酸酐,选项A不正确; B.化合物 不能发生消去反应,选项B不正确;C.化合物
不能发生消去反应,选项B不正确;C.化合物![]() 不含酚羟基,不能与氯化铁反应呈紫色,选项C正确;D.
不含酚羟基,不能与氯化铁反应呈紫色,选项C正确;D.  的分子式是C9H11NO3,选项D正确;答案选AB;(4)环己烷与氯气发生取代反应生成
的分子式是C9H11NO3,选项D正确;答案选AB;(4)环己烷与氯气发生取代反应生成![]() ,
,![]() 在氢氧化钠的醇溶液中加热发生消去反应生成
在氢氧化钠的醇溶液中加热发生消去反应生成![]() ,
,![]() 再与氯气发生加成反应生成
再与氯气发生加成反应生成![]() ,
,![]() 在氢氧化钠的水溶液中发生水解反应生成
在氢氧化钠的水溶液中发生水解反应生成![]() ,故合成路线为:
,故合成路线为: ![]() ;(5)符合条件的D的所有同分异构体①分子中有硝基,②1H-NMR谱表明分子中有3种氢原子,则高度对称,含有三个甲基且甲基中有两个等效;IR谱显示存在苯环,符合条件的有:
;(5)符合条件的D的所有同分异构体①分子中有硝基,②1H-NMR谱表明分子中有3种氢原子,则高度对称,含有三个甲基且甲基中有两个等效;IR谱显示存在苯环,符合条件的有: 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)请按要求写出下列反应的化学方程式或离子方程式_______。
①物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,写出该反应的化学方程式________。
②ClO2常用于水的净化,工业上可用Cl2氧化Na ClO2溶液制取ClO2.写出该反应的离子方程式:__________。
③Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为________。
④NaBH4是一种重要的储氢载体,能与水反应达到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________。
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。反应的化学方程式中x=_________。
(2)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图。下列关于反应的说法错误的是

A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有着悠久的文明历史,其中青铜、陶瓷、造纸及黑火药等与现代化学科密切相关。下列说法中正确的是( )
A. 青铜的熔点比纯铜和锡都高 B. 陶瓷的主要成分为硅酸盐
C. 古代的纸张主要成分为蛋白质 D. 黑火药爆炸时,氧化剂只有硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下。回答下列问题(注:Na2O2可以与H2O、CO2反应):
(1)装置Ⅳ中盛放的药品是________,其作用是_______________________________。

(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)____________,各仪器接口的标号字母(a、b……)顺序是:空气进入________,________接________,________接________,________接________。
(3)装置Ⅱ的作用_________________________________________。
(4)操作中通空气和加热的顺序为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料.由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:

回答下列问题:
(1)A的名称是____________,B含有的官能团是____________;
(2)①的反应类型是____________,⑦的反应类型是____________;
(3)C和D的结构简式分别为____________、____________;
(4)异戊二烯分子中最多有__________个原子共平面,顺式聚异戊二烯的结构简式为____________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体(写结构简式)________________________________________________;
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的原子序数为17,35Cl是氯的一种核素,下列说法正确的是
A. 35Cl原子所含质子数为18 B. 1mol的1H35Cl分子所含中子数约为18个
C. 7.0g的35Cl2气体的体积为2.24L D. 35Cl2气体的摩尔质量为70g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激性气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:A______,B______,C______,D______,E______,F______。
(2)写出A、B跟水反应的离子方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。现有下列两种制备ClO2的方法:
(1)方法一:可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl===5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因______。
(2)方法二:氯化钠电解法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO![]() 等杂质。某次除杂操作时,往粗盐水中先加入过量的_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
等杂质。某次除杂操作时,往粗盐水中先加入过量的_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,氯化钠电解槽中阳极反应方程式为__________________,二氧化氯发生器中生成ClO2的化学方程式为_______________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com