
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
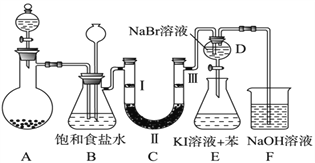
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:______。装置B中饱和食盐水的作用是________________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度为0.1000mol/L的NaOH溶液来测定未知物质的量浓度的盐酸,选择酚酞作指示剂.请填写下列空白:![]()
(1)如图仪器的名称是 .
(2)用标准的氢氧化钠溶液滴定待测的盐酸时,左手挤压橡皮管中玻璃小球,右手摇动锥形瓶,眼睛注视 , 滴定终点的判断方法是 .
(3)根据下面表格数据,可计算出该盐酸的浓度约为(保留两位有效数字).
实验 | NaOH溶液的 | 滴定完成时,溶液滴入的体积/mL aOH | 待测盐的体积/mL酸 |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列对溶液中溶质组成成分判断正确的是( )
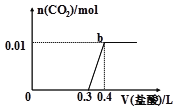
A. 原溶液中溶质为Na2CO3和NaHCO3
B. 原溶液中溶质为NaOH和Na2CO3
C. 原溶液中溶质为Na2CO3
D. 原溶液中溶质为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去.已知室温下Ksp(FeS)=6.3×10﹣18mol2L﹣2 , Ksp(CuS)=1.3×10﹣36mol2L﹣2 . ①请用离子方程式说明上述除杂的原理 .
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
A.Ba(NO3)2B.BaCl2
C.Ba(OH)2D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 .
(2)电解法处理酸性含铬废水(主要含有Cr2O72﹣)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是(填序号)
A.阳极反应为Fe﹣2e﹣═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72﹣被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池.图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态烃在标准状况下的体积为2.8 L,其质量为2 g,该烃中氢元素的质量分数为25%,则该烃的分子式为________,电子式为____________,结构式为____________,其立体构型为________。
(2)如图立方体中心的“●”表示甲烷分子中的碳原子,请在立方体的顶点用“●”表示出与之紧邻的4个氢原子的位置。______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于硫酸和硝酸的比较中,下列叙述不正确的是
A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装
B.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性
C.稀硫酸和稀硝酸都具有氧化性
D.硫酸和硝酸都是重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
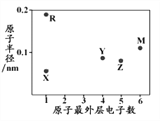
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com