
����Ŀ�����ڱ��е�����Ԫ��A��B��D��E��F��ԭ��������������A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊnsnnpn��B�Ļ�̬ԭ��2p�ܼ���3�������ӣ�D��һ�ָ����ں�ˮ�е�Ԫ�أ�����λ�ں�ˮ�и�Ԫ�صĵ���λ��E2+��3d�������10�����ӣ�Fλ�ڵ������ڣ���Cuͬ�壬�䵥���ڽ������˳���������ĩλ��
��1��д��E�Ļ�̬ԭ�ӵļ۲�����Ų�ʽ___________��
��2��A��B�γɵ�AB������Ϊ��λ�������е����壬��Aԭ�ӵ��ӻ���ʽΪ________��AB���к��е���������������Ŀ֮��Ϊ________��
��3��FD3��һ�ֺֺ�ɫ���壬��ʪ�Լ�ǿ��������ˮ���Ҵ��������ǹ�̬��������̬���������Զ�����F2D6����ʽ���ڣ�����������Ϣ�ж�FD3������Ľṹ����____���壬д��F2D6�Ľṹʽ________��
��4��E��F������AB���γ������ӣ���֪E��AB���γɵ�������Ϊ���������Ρ�F(+1��)��AB�γɵ�������Ϊֱ���Σ���ҵ�ϳ���F��AB���γɵ���������E��Ӧ����ȡF���ʣ�д��E�û�F�����ӷ���ʽ_________________��
��5��F���ʵľ���Ϊ�����������ܶѻ�����F��ԭ�Ӱ뾶Ϊa nm��F���ʵ�Ħ���ĵ�����ΪMg/mol�������ӵ�����ΪNA����F���ʵ��ܶ�Ϊ______g/cm3��(��a��NA��M�Ĵ���ʽ��ʾ)
���𰸡�3d104s2 sp 1��2 ���� 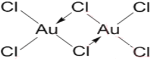 Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2- ![]()
��������
���ڱ��е�����Ԫ��A��B��D��E��F��ԭ��������������A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊnsnnpn����ônֻ��Ϊ2����A�Ļ�̬ԭ�Ӽ۲�����Ų�Ϊ2s2p2��AΪCԪ�أ�B�Ļ�̬ԭ��2p�ܼ���3�������ӣ���ôB�ļ۲�����Ų�ʽΪ2s22p3��B��NԪ�أ�D��һ�ָ����ں�ˮ�е�Ԫ�أ�����λ�ں�ˮ�и�Ԫ�صĵ���λ����ôD��ClԪ�أ�E2+��3d�������10�����ӣ�E��ZnԪ�أ�Fλ�ڵ������ڣ���Cuͬ�壬�䵥���ڽ������˳���������ĩλ��F��Au�����ڴ˻������������ʽṹ����֪ʶ���С�⡣
���ݷ�����A��B��D��E��F�ֱ�ΪC��N��Cl��Zn��Au��
(1)E��пԪ�أ��˵����Ϊ30����Ԫ�����ڱ��е�λ��Ϊ�������ڢ�B�壬E�Ļ�̬ԭ�ӵļ۲�����Ų�ʽ3d104s2����Ϊ��3d104s2
(2)A��B�γɵ�AB-����CN-��Cԭ�ӵļ۲���Ӷ���Ϊ1+(4+1-1��3)/2=2��Ϊsp�ӻ���CN-����һ������������һ��Ϊ����������2��Ϊ�м���������м�����Ŀ֮��Ϊ1��2����Ϊ��sp��1��2
(3)AuCl3��һ�ֺֺ�ɫ���壬��ʪ�Լ�ǿ��������ˮ���Ҵ����Զ�����Au2Cl6����ʽ���ڣ���2��AuCl3Ӧͨ����λ����ϣ�AuΪ����ԭ�ӣ�ClΪ��λԭ�ӣ��γɵĶ�����Au2Cl6Ϊ���ӣ����Կ��ж�AuCl3�������ڷ��Ӿ��壬�ṹʽΪ�� ����Ϊ�����ӣ�
����Ϊ�����ӣ�
(4)Au(+1��)��CN-�γɵ�ֱ����������Ϊ[Au(CN)2]-��Zn��CN-�γɵ�����������������Ϊ [Zn(CN)4]2-����Zn��ȡAu���ʵķ�Ӧ���û���Ӧ�����ӷ���ʽΪ��Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-����Ϊ��Zn+2[Au(CN)2]- =2Au+[Zn(CN)4]2-
(5)F�� Au���䵥�ʵľ���Ϊ�����������ܶѻ���ÿһ��Au�ľ����к���4��Auԭ�ӣ�ÿһ������������Ϊ![]() ������
������ =
=![]() g cm-3������
g cm-3������![]()



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�������������ȷ����
A. ��ͬһ��Ͳ�Ⱥ��ȡ80 mL������20 mLˮ����������ȫ�ܽ⣬��Һ��Ϊ����ɫ
B. �ڱ������м��������������ټ���3 mLŨ���ᣬ���裬��������ɫ���ɫ
C. ���������ˮ��Һ�еμ��Ȼ�����Һ���ٵμ�˫��ˮ��������ɫ����
D. ����ȼ���þ���������������̼�ļ���ƿ��þ������ȼ�գ��а�ɫ����ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�����ش��������⣺
��1���¹���ѧ��F.Haber��1902�꿪ʼ�о�N2��H2ֱ�Ӻϳ�NH3����1.01��105Pa��250��ʱ����1 molN2��1 molH2����aL���������г�ַ�Ӧ�����NH3�������Ϊ0.04�������������䣬�¶�������450�棬���NH3�������Ϊ0.025������жϺϳɰ���ӦΪ ____������������������������Ӧ��
��2����1.01��105Pa��250��ʱ����2 moIN2��2 molH2����aL�ܱ������г�ַ�Ӧ��H2ƽ��ת���ʿ���Ϊ ___�����ţ���
A =4% B <4% C 4%��7% D >11.5%
��3���ҹ���ѧ�ҽ��ʵ��������ģ�������о�����������W18049����Ӧ������������ʵ�ֳ��µ͵�λ�ϳɰ�����ýϸߵİ������ͷ�����Ч�ʡ���Ӧ������ͼ��ʾ�����������ڴ��������������*��ע��
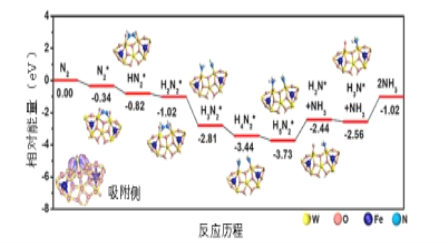
��Ҫ���������������ݣ���ܣ�E=____ev���ò���Ļ�ѧ����ʽΪ____����ͨ��H2���������������� ___��
��4��T��ʱ���ں��º��ݵ��ܱ������·�����Ӧ��![]() ��Ӧ�����и�����Ũ�ȵı仯������ͼ��ʾ��
��Ӧ�����и�����Ũ�ȵı仯������ͼ��ʾ��
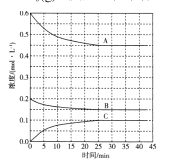
�ٱ�ʾN2Ũ�ȱ仯�������� ____������A������B������C���������루1���е�ʵ��������1.01��105Pa��450�棩��ȣ��ı������������_____��
����0��25min��H2��ƽ����Ӧ����Ϊ____���ڸ������·�Ӧ��ƽ�ⳣ��Ϊ ___mol-2��L2��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ�������йظ��л����˵����ȷ����
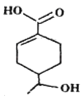
A.�����к������ֹ�����
B.1mol���л�����ȫȼ������O2�����ʵ���Ϊ10mol
C.�ܷ����ӳɡ�ȡ����ˮ��ȷ�Ӧ
D.��ͬ�����£������ĸ��л���ֱ���������Na��NaHCO3��Һ��Ӧ���������������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廯ͭ(II)�������������һ���Ʊ��л������Ĵ�������ϳɷ������£�
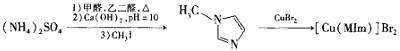
��1��ͭԪ��λ�����ڱ��е�_____�壬д����̬Cu2+�ĵ����Ų�ʽ_______��
��2����![]() ��Ϊ�ȵ������������Ϊ_______��
��Ϊ�ȵ������������Ϊ_______��
��3��![]() ����ԭ�ӵ��ӻ���ʽΪ_________��
����ԭ�ӵ��ӻ���ʽΪ_________��
��4��MIm�к�����������Ŀ֮��Ϊ__________��
��5��һ��ͭ���廯�ᄃ���ṹ��ͼ��ʾ��
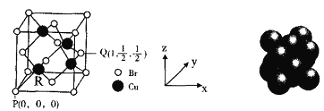
��ͼ��P���Q���ԭ�������������ȷ��R���ԭ���������Ϊ______��
��6��Cu����Ķѻ���ʽΪ�����������ܶѻ�����Cuԭ�Ӱ뾶Ϊa��������Cuԭ�ӵ���λ��Ϊ________������Ŀռ�������Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̪(J)�������ᡢ�жȼ�����ȱѪ��ҩ��ϳ�J��һ��·�����£�
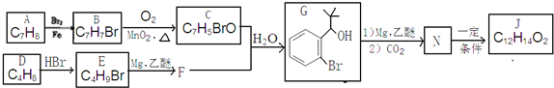
��֪����R-Br![]()
��E�ĺ˴Ź�������ֻ��һ��壻
��C�ܷ���������Ӧ��
��J��һ�����������г����������һ����Ԫ����
�ش��������⣺
(1)��A����B�Ļ�ѧ����ʽΪ__________���䷴Ӧ����Ϊ__________��
(2)D�Ļ�ѧ������__________����D����E�Ļ�ѧ����ʽΪ__________��
(3)J�Ľṹ��ʽΪ__________��
(4)G��ͬ���칹���к˴Ź���������4���������FeCl3��Һ������ɫ��Ӧ�Ľṹ��ʽ__________(д��һ�ּ���)��
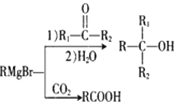
(5)�ɼ�ȩ�ͻ�����A�����в���ɵõ�2�������Ҵ���A![]() K
K![]() L
L![]()
![]() ����Ӧ����1Ϊ__________����Ӧ����2��ѡ����Լ�Ϊ__________��L�Ľṹ��ʽΪ__________��
����Ӧ����1Ϊ__________����Ӧ����2��ѡ����Լ�Ϊ__________��L�Ľṹ��ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)�ǹ㷺������ҵ����������ӽṹ������ͼ��ʾ�������£�S2Cl2��ˮ��ˮ�⣬��������ʹƷ����ɫ�����塣����˵��������ǣ� ��
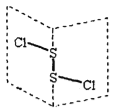
![]()
A. S2Cl2�ĵ���ʽΪ
B. S2Cl2ͬʱ���м��Լ��ͷǼ��Լ�
C. S2Br2��S2Cl2�ṹ���ƣ��۷е㣺S2Br2 > S2Cl2
D. S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ�� 2S2Cl2+2H2O = SO2��+3S��+4HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������˵�����δ��ʱϴ������Һ�к�NaCl�������ñ����ʴ�����ֺ��ɫ��ߡ���ʴԭ����ͼ��ʾ������˵����ȷ����
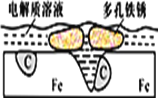
A. ��ʴ�����У�������C
B. Feʧȥ���Ӿ��������Һת�Ƹ�C
C. �����ĵ缫��ӦʽΪ4OH�D��4e��==2H2O��O2��
D. C��������O2��C�����Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֿ��ɷ�ȩ��֬�Ͳ�����ά�Ƴɡ�
��1����ȩ��֬�ɷ�ȩ�ͼ�ȩ���۶��ɣ���Ӧ�д����ȷų���Ϊ��ֹ�¶ȹ��ߣ�Ӧ���б��ӵķ�Ӧ��___________�����ȩ���ҷ�Ӧ��Ӧװ��________________װ�á�
��2��������ά�ɲ�����˿�õ�����ͨ������ʯӢɰ��___________��ʯ��ʯ����ʯ���������ڶ��ɣ���Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________��
��3���������в�����ά��������____________�������־���__________���������ܣ�д�����㼴�ɣ�
��4�����д����Ͼ��ȹ��Է�ȩ���ϵ�������������_____________
a.����
b.�����������֬����
c.����ȼ��
d.���л��ܼ������ܽ⣬������֬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com