
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
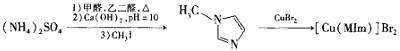
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与![]() 互为等电子体的阴离子为_______。
互为等电子体的阴离子为_______。
(3)![]() 中心原子的杂化方式为_________。
中心原子的杂化方式为_________。
(4)MIm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如图所示。
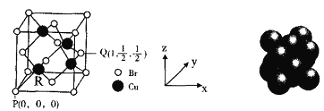
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。
(6)Cu晶体的堆积方式为面心立方最密堆积,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为_______________。
【答案】ⅠB 1s22s22p63s23p63d9或[Ar]3d9 ![]() (或其它合理答案) sp3 9:2 (
(或其它合理答案) sp3 9:2 (![]() ,
,![]() ,
,![]() ) 12 74.76%
) 12 74.76%
【解析】
(1)Cu失电子时,先失4s电子;
(2)等电子体具有相同的原子数和价电子总数;
(3)中心原子的杂化方式可根据价层电子对数的计算结果作出判断;
(4)MIm结构为![]() ,含2个双键、7个单键,依此可计算σ键和π键数;
,含2个双键、7个单键,依此可计算σ键和π键数;
(5)可将该晶胞切成完全相同的8个小平行六面体,R便在小平行六面体的体心,依此可判断其原子坐标;
(6)利用均摊法计算该晶胞所含各种粒子的个数,并计算出Cu的总体积;晶体中距离最近的原子可视着相切,根据这点可计算出晶胞的体积,进一步便可计算出空间利用率。
(1)铜元素原子序数为29,位于周期表中第四周期、ⅠB族,所以Cu电子数为29,基态Cu2+的电子排布式为1s22s22p63s23p63d9或[Ar]3d9。答案为:ⅠB;1s22s22p63s23p63d9或[Ar]3d9
(2)![]() 含5个原子、价电子数为8,所以与之互为等电子体的阴离子有
含5个原子、价电子数为8,所以与之互为等电子体的阴离子有![]() 或
或![]() 等离子。答案为:
等离子。答案为:![]() (或其它合理答案)
(或其它合理答案)
(3)![]() 中,价层电子对数=
中,价层电子对数= ![]() (中心原子的价电子数+配位原子的成键电子数±电荷数)=
(中心原子的价电子数+配位原子的成键电子数±电荷数)= ![]() (6+2)=4,杂化轨道数4,采取sp3杂化。答案为:sp3
(6+2)=4,杂化轨道数4,采取sp3杂化。答案为:sp3
(4)MIm结构为![]() ,分子中双键数2,其中π键数目为2,σ键数目为2;单键数为7,均为σ键。所以σ键总数为7+2=9,Mlm中含σ键与π数目之比为9:2。答案为:9:2
,分子中双键数2,其中π键数目为2,σ键数目为2;单键数为7,均为σ键。所以σ键总数为7+2=9,Mlm中含σ键与π数目之比为9:2。答案为:9:2
(5)图中P点坐标参数(0,0,0)和Q点原子坐标参数(1,![]() ,
,![]() ),可将晶胞边长设为1,PR点为晶胞对角线的
),可将晶胞边长设为1,PR点为晶胞对角线的![]() ,则可确定R点的原子坐标参数为(
,则可确定R点的原子坐标参数为(![]() ,
,![]() ,
,![]() )。答案为:(
)。答案为:(![]() ,
,![]() ,
,![]() )
)
(6)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;以顶点Cu原子进行研究,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故Cu原子配位数为![]() ;晶胞中Cu原子数目为8×
;晶胞中Cu原子数目为8×![]() +6×
+6×![]() =4,设Cu原子半径为a,则Cu原子总体积为4×
=4,设Cu原子半径为a,则Cu原子总体积为4× ![]() πa3,晶胞棱长=4a×
πa3,晶胞棱长=4a×![]() =2
=2![]() a,晶胞体积为(2
a,晶胞体积为(2![]() a)3,晶胞空间利用率=
a)3,晶胞空间利用率=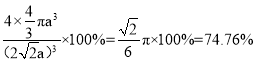 =
= ![]() =74.76%。答案为:12;74.76%
=74.76%。答案为:12;74.76%


科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入![]() 溶液中,可用于除去工业废气中的
溶液中,可用于除去工业废气中的![]()
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多![]() 等)不利于作物生长,可施加熟石灰进行改良
等)不利于作物生长,可施加熟石灰进行改良
D. 无水![]() 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于1L pH=3的H2SO4溶液说法正确的是
A.与等体积pH=11氨水混合后所得溶液pH小于7
B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7
C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3
D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,30g乙烷气体中所含有的共价键数目为7NA
B.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子
C.0.5mol雄黄(As4S4,结构为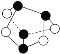 )中含有NA个S—S键
)中含有NA个S—S键
D.6.0gSiO2晶体中含有的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在化肥生产、储氢及环境治理等领域发挥着重要作用。
(1)中科院固体研究所的赵惠军和张海民研究团队以MoS2为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图1。将Na2SO4溶液换成Li2SO4溶液后,反应速率明显加快的主要原因是加快了下列__转化的反应速率(填标号)。
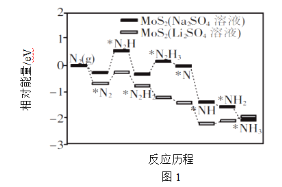
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
(2)2017年Dr.KatsutoshiNagaoka等带领的研究团队开发了一种可以“快速启动的氨制氢工艺”。
已知:NH3(g)=![]() H2(g)+
H2(g)+![]() N2(g) ΔH1=+45.9kJ·mol-1
N2(g) ΔH1=+45.9kJ·mol-1
NH3(g)+![]() O2(g)=
O2(g)=![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH2=-318kJ·mol-1
N2(g) ΔH2=-318kJ·mol-1
则快速制氢反应NH3(g)+![]() O2(g)=H2(g)+
O2(g)=H2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g)的ΔH=___kJ·mol-1。
N2(g)的ΔH=___kJ·mol-1。
(3)氨在高温下分解可以产生氢气和氮气。1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:

表中的t5的值为___。c(NH3)的值从2.28×10-3变化至1.14×10-3的过程中,平均反应速率v(H2)=___ mol·L-1·s-1(保留三位有效数字)。
(4)氨催化氧化时会发生两个竞争反应:
Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
Ⅱ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
为分析某催化剂对反应的选择性,在1L密闭容器中存入1mol氨气和2mol的氧气,测得有关物质的物质的量随温度变化的关系如图2。
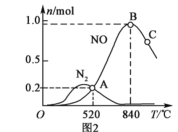
①该催化剂在低温时,选择反应___(填“Ⅰ”或“Ⅱ”)。
②520℃时,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
(5)华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图3所示。
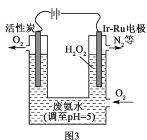
①IrRu惰性电极有吸附O2的作用,该电极上的反应为__。
②理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn;B的基态原子2p能级有3个单电子;D是一种富集在海水中的元素,含量位于海水中各元素的第三位;E2+的3d轨道中有10个电子;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位。
(1)写出E的基态原子的价层电子排布式___________。
(2)A、B形成的AB﹣常作为配位化合物中的配体,其A原子的杂化方式为________,AB﹣中含有的σ键与π键的数目之比为________。
(3)FD3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体F2D6的形式存在,依据以上信息判断FD3,晶体的结构属于____晶体,写出F2D6的结构式________。
(4)E、F均能与AB﹣形成配离子,已知E与AB﹣形成的配离子为正四面体形。F(+1价)与AB形成的配离子为直线形,工业上常用F和AB﹣形成的配离子与E反应来提取F单质,写出E置换F的离子方程式_________________。
(5)F单质的晶体为面心立方最密堆积,若F的原子半径为a nm,F单质的摩尔的的质量为Mg/mol,阿伏加德罗常数为NA,求F单质的密度为______g/cm3。(用a、NA、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
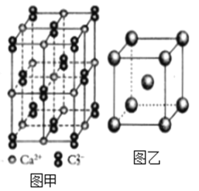
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
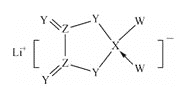
A.W的非金属性比Y的强 B.在该物质中Ⅹ原子满足8电子稳定结构
C.该物质中含离子键和共价键 D.Z的氧化物都易溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
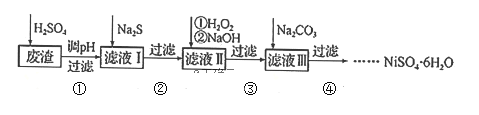
已知:①![]() 是一种不溶于水易溶于强酸的沉淀;②已知
是一种不溶于水易溶于强酸的沉淀;②已知![]() ,
,![]() 的
的![]() 。
。
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是___________。若在![]() 时,调pH=4除去铁,此时溶液中
时,调pH=4除去铁,此时溶液中![]() ______________。
______________。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是_ ___(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com