
����Ŀ�����Ѿ��г���������������ΪʳƷ���Ӽ���Ϊ���ij���Ѿ���Ʒ���������εĺ���(ͨ���Ծ�����SO2������)��ij�о�С�����������ʵ��(��֪��ԭ�ԣ�SO32->I->Cl-)��
![]()
����˵������ȷ����
A. ���Լ�Aѡ����ˮ�����Լ�B��ѡ��NaOH��Һ
B. ͨ��N2����е�Ŀ����Ϊ�˽��������������Һ��ȫ���ϳ�
C. ���Ѿ��м��������ε���ҪĿ���Ƿ�ֹ�������������������εĻ�ԭ��
D. ���Լ�Aѡ���Һ���������պ���ҺΪ���ԣ����Լ�B��ѡ��I2��Һ
���𰸡�A
�����������������A������������л�ԭ�ԣ����Ա���ˮ����Ϊ���ᣬ������ˮҲ���Ժ���������֮�䷴Ӧ�����Դ�ʱ����ѡ��NaOH��Һ��A����B��������������֪����ͨ������Ϊ�˽����ɵĶ����������Һ��ȫ���ϳ���B��ȷ��C��������������ױ������е���������Ϊ����������Ѿ��м��������ε���ҪĿ���Ƿ�ֹ���Ѿ��������������������εĻ�ԭ�ԣ�C��ȷ��D�����Լ�Aѡ���Һ�����ԺͶ�������֮�䷴Ӧ�õ��������λ������������Σ����ο��Ա��ⵥ������Ϊ�����Σ��Լ�B��ѡ��I2��Һ��D��ȷ����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������2L���ܱ������У�����2mol SO2��1molO2������Ӧ:2SO2��g�� + O2��g�� ![]() 2SO3��g����H=��196kJmoL-1��������������ʵ�������0.8molʱ��Ӧ�ﵽƽ�⣬�����й���������ȷ���ǣ� ��
2SO3��g����H=��196kJmoL-1��������������ʵ�������0.8molʱ��Ӧ�ﵽƽ�⣬�����й���������ȷ���ǣ� ��
A�������¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��V(��)��V(�棩
B����ͬ�¶��£���ʼʱ�������г���2mol SO3����ƽ��ʱSO3��ת����Ϊ20%
C��ƽ����������S02�����ʵ���Ϊ1.2mol
D�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����39.2kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����(����)
A. ���ڷ�ӦTiCl4��4Na===Ti��4NaCl������ԭ��
B. NaOHӦ�ܷⱣ�棬�Է��ֽ����
C. ʢ��KOH��Һ���Լ�ƿ�����ò�����
D. ��������CO2ͨ�뱥��NaOH��Һ�У����й�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ�峣�õ�һ�ֹ����漰���¹��̣�
����������Cl2����ˮ�е�NaBr������Br2��
�ڽ���ˮŨ����
����ȡ����Cl2��HBr������Br2�õ���Ʒ��
�ܸ������ÿ�����ˮ������Br2���������������ռ�SO2ˮ��Һ��Ӧ����HBr������ȷ�IJ���Ϊ(�� ��)
A. �ڢ٢ۢ� B. �٢ڢۢ� C. �ڢ٢ܢ� D. �ۢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����ӻ������Dz���������˼���������˶����д��ص�
B.Ӣ����ѧ�ҵ��������ȷ����˵���
C.��ɫ��Ӧ�����ԾǨ�йأ����ڻ�ѧ�仯
D.��̬��ԭ��ת��ɼ���̬��ԭ��ʱ�ͷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�ȼ�ϵ����Ŀǰ������ɹ���ȼ�ϵ��֮һ������ȼ�ϵ���ɼ״�������(����)��KOH(�������Һ)���ɣ���ص��ܷ�ӦʽΪ2CH3OH+3O2+4OH���T2CO32��+6H2O��������˵����ȷ����
A. ��طŵ�ʱͨ������ĵ缫Ϊ����
B. ����CO32��ˮ���Լ��ԣ���طŵ�ʱ���������Һ��pH������
C. ��طŵ�ʱ�����ĵ缫��ӦʽΪCH3OH+8OH����6e���TCO32��+6H2O
D. ��طŵ�ʱÿ����1 mol CH3OHת��8 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪԪ�����ڱ��ж����ڵ�һ���֣� ![]() ����Ԫ����ֻ��һ���ǽ���������˵��������ǣ� ��
����Ԫ����ֻ��һ���ǽ���������˵��������ǣ� ��
A.��̬�⻯���ȶ��ԣ�R��Q
B.Ԫ��T�����ӽṹʾ��ͼΪ 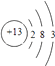
C.��Wͬ�����ijԪ���γɵ�18���ӵ��⻯������м��м��Լ����зǼ��Լ�
D.Q��һ��ͬλ�ؿ����ڲⶨ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵڢ�A��Ԫ�أ����飨As4������Ԫ�ص�һ�ֵ��ʣ�����ӽṹ����ף�P4�����ơ����й��ڻ���Ͱ���������ȷ���ǣ���
A.����Ͱ������й��ۼ��ļ��Ǿ�Ϊ109.5o
B.��������й��ۼ��ļ��ܴ��ڰ�����
C.������ӵļ��Դ��ڰ�����
D.������۵���ڰ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��10g̼������������ᷴӦ��������������ʵ���Ϊ���٣����ɶ�����̼������������״����Ϊ���٣���Ҫ��д����ѧ��Ӧ����ʽ������ʽ���㣩
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com