
| A、200 mL 0.25 mol/L NaCl溶液 |
| B、200 mL 1 mol/L NaCl溶液 |
| C、100 mL 0.5 mol/L NaOH溶液 |
| D、100 mL 2 mol/L NaOH溶液 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、称量时,将NaOH固体直接放在托盘天平的左盘上 |
| B、将NaOH固体在烧杯中溶解后立即转移至容量瓶中 |
| C、定容时,俯视容量瓶的刻度线会使所配溶液的浓度偏高 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2SO2+O2
| |||
| B、C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol | |||
C、500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| D、2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ/moL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焦炭是铁矿石炼铁时的还原剂 |
| B、焦炭先与空气中的氧气反应,为炼铁提供能量 |
| C、石灰石是助矿石中杂质形成炉渣 |
| D、固体原料需粉碎,增大与气体的接触面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、洗净的锥形瓶和滴定管可以放进烘箱中烘干 |
| D、氢氟酸试剂和NaOH溶液不可用带玻璃塞的玻璃瓶存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3═2Na++CO32- |
| B、NaHCO3═Na++HCO3- |
| C、H2SO4═2H++SO42- |
| D、KClO3═K++Cl-+3O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
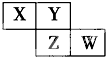 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、与H2化合,Z比W更容易 |
| D、形成的气态氢化物溶于水,溶液呈碱性的是:X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com