
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
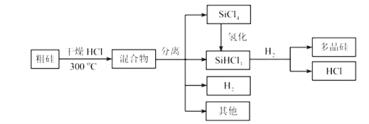
回答下列问题:
(I)硅粉与HCl在300℃时反应生成1mol SiHCl3气体和![]() ,放出225kJ热量,该反应的热化学方程式为________________________。
,放出225kJ热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
(II)将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0
③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3
3SiHCl3△H3
反应③的![]() ______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
______(用△H1,△H2表示)。温度升高,反应③的平衡常数K______(填“增大”、“减小”或“不变”)。
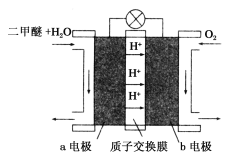
(III)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________极。请写出负极的电极反应方程式:__________________
【答案】Si(s)+3HCl(g)![]() SiHCl(g)+H2(g)△H=-225KJ/mol
SiHCl(g)+H2(g)△H=-225KJ/mol 
![]() 减小 正 C2H6O-12e-+3H2O=2CO2+12H+
减小 正 C2H6O-12e-+3H2O=2CO2+12H+
【解析】
(I)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,根据反应热及反应物状态、反应条件书写该反应的热化学方程式为Si(s)+3HCl(g)![]() SiHCl(g)+H2(g)△H=-225KJ/mol,SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为
SiHCl(g)+H2(g)△H=-225KJ/mol,SiHCl3中存在1个Si-H键、3个Si-Cl键,其电子式为 ;
;
(Ⅱ)①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0②3SiCl4(g)+2H2(g)+Si(s)
SiHCl3(g)+HCl(g)△H1>0②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0将方程式②-①得③3SiCl4(g)+H2(g)+Si(s)+HCl(g)
4SiHCl3(g) △H2>0将方程式②-①得③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3=H2-H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
3SiHCl3△H3=H2-H1<0,升高温度平衡向吸热方向移动,该反应的正反应是放热反应,升高温度平衡逆向移动,所以升高温度反应③的平衡常数K减小;
(Ⅲ)根据电池示意图,该电池的总反应为CH3OCH3+3O2=2CO2+3H2O,二甲醚为负极失电子,电极方程式为CH3OCH3-12e-+3H2O=2CO2+12H+,氧气为正极得电子,电极方程式为O2+4e-+4H+=2H2O。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O![]() HS-+OH-。下列说法正确的是( )
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+=Cu2++Fe2+
C.向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D.用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-=Mn2++2H2O+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H均为中学化学常见的物质,A、B、C、E的焰色反应均为黄色。其中B常做食品的膨化剂;A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色无味的气体D地放出;X为一种黑色固体单质,有多种同素异形体,其氧化性参与大气循环,为温室气体;G为冶炼铁的原料,G溶于盐酸中得到两种化合物。A~H之间有如下的转化关系(部分物质未写出):
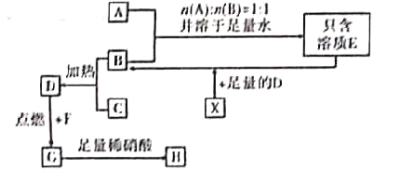
(1)写出该物质的化学式:C:_______;E:_____。
(2)B+C→D的反应中,每生成标准状况下11.2 L D,转移电子的物质的量为_____mol。
(3)已知F与高温水蒸汽也能反应生成G,该反应中,还原剂与还原产物的物质的量之比为_____。
(4)写出G与足量稀硝酸反应的离子方程式_______________。
(5)G在高温下与铝反应的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
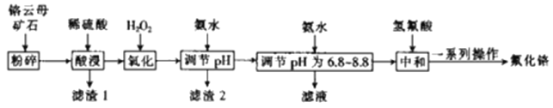
下表列出了相关金属离子生成氢氧化物沉淀的pH:
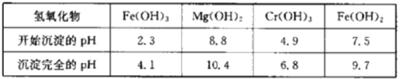
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有___种。
(2)将铬云母矿石粉碎的目的是___。
(3)滤渣1主要成分的用途是___。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___。
(5)第一次滴加氨水调节pH范围为___。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是___,Cr(OH)3与Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )

A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
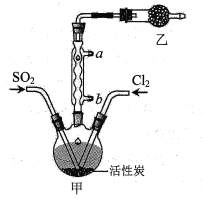
I.SO2Cl2的制备
(1)水应从___(选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___(填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___。
(5)反应结束后,分离甲中混合物的最佳实验操作是___。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___。
(7)产品中SO2Cl2的质量分数为___%,若步骤③不加入硝基苯则所测SO2Cl2含量将___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 检验蔗糖水解生成葡萄糖 | 取适量蔗糖溶于盛有蒸馏水的试管中,滴入稀硫酸加热一段时间,冷却,滴入新制氢氧化铜悬浊液,加热至沸腾,观察有无砖红色沉淀 |
B | 实验室制备氢氧化铁胶体 | 向盛有25mL蒸馏水的烧杯中滴入5-6滴氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 |
C | 比较AgCl、AgI的Ksp大小 | 向盛有10滴0.1mol/LAgNO3 溶液的试管中滴加0.1mol/LNaCl溶液至不再有沉淀生成,再滴加0.1mol/lKI溶液 |
D | 比较Mg、Al的金属性强弱 | 用导线连接镁和铝片,插入盛有氢氧化钠溶液的烧杯中,观察气泡 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com