
【题目】下列分子的中心原子是 sp2 杂化的是( )
A.CH4B.BF3C.H2OD.NF3
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是

A. d为锌块,铁片不易被腐蚀
B. d为锌块,铁片上电极反应为2H++2e-==H2↑
C. d为石墨,铁片腐蚀加快
D. d为石墨,石墨上电极反应为O2+2H2O+4e-==4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.
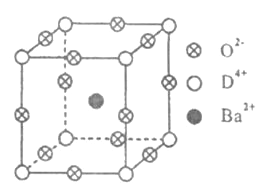
请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________(填元素符号).
(2)BA4分子的空间构型是______________;B原子轨道的杂化类型为_____.
(3)C的气态氢化物的电子式为____;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________.
(4)D的基态原子核外电子排布式为____________________.
(5)①制备化合物甲的化学方程式为____________________.
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________.
③在甲晶体中,D4+的氧配位数为__________.
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________g/cm3(要求列出算式,阿伏加德罗常数用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠反应的是
①NaHCO3②Al2O3③Al(OH)3④Al ⑤NaHSO4⑥AlCl3⑦NaAlO2
A. ①⑤ B. ②③④⑥⑦ C. ①②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,4g H2,11.2L O2,1mol H2O中,所含分子数最多的是______,含原子数最多的是________,质量最大的是________,体积最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250mL 0.5mol/L NaOH溶液,在下列仪器中:A. 托盘天平 B. 量筒 C.烧杯 D. 玻璃棒 E. 漏斗 F. 500mL容量瓶 G. 药匙 H. 250mL容量瓶 I. 胶头滴管 J. 坩埚。需要用到的仪器有______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置进行实验,下列说法错误的是
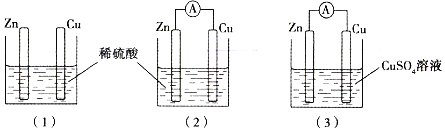
A. 若使图(1)装置中的Zn棒和Cu棒直接接触,则Cu棒上能看到有气体产生
B. 图(2)装置中SO42-向着Zn棒移动
C. 若将图(2)装置中Zn改为Mg,则Cu棒上产生气体的速率加快
D. 当图(2)装置与图(3)装置中正极生成物的质量比为1∶16时,两装置中Zn棒减轻的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.反应产物的总焓与反应物的总焓之差,称为反应焓变
B.反应产物的总焓小于反应物的总焓,该反应为吸热反应
C.同一反应在不同温度下进行,其焓变是不同的
D.已知2NO2(g)=N2O4(g) △H1,N2O4(g)=2NO2(g) △H2,则△H1=-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
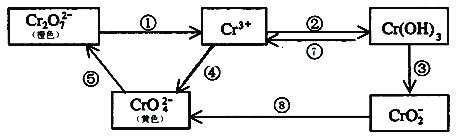
完成下列填空:
(1)①步中含Cr2O![]() 离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:___________________________________;
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O
②2S2O32-+ I2 =S4O62-+2I-,准确称取纯净的K2Cr2O7 0.294g配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为________________________;
②滴定时加入的指示剂通常为_________,滴定至终点的现象是_______________________________;
③Na2S2O3溶液的物质的量浓度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com