
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( )
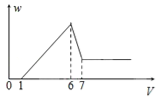
A. 2:3 B. 1:1 C. 4:3 D. 8:9
【答案】D
【解析】试题分析:生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol,根据Al(OH)3+NaOH=NaAlO2+2H2O,计算氢氧化铝物质的量,再根据生成沉淀消耗NaOH计算氢氧化镁物质的量,根据元素守恒计算Mg、Al质量之比.
解:生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol,
Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
由Al元素守恒,可知m(Al)=1mol×27g/mol=27g,
生成1mol氢氧化铝消耗NaOH为1mol×3=3mol,则生成氢氧化镁消耗NaOH为5mol﹣3mol=2mol,则氢氧化镁为1mol,由Mg元素守恒,则m(Mg)=1mol×24g/mol=24g,
故该合金中镁和铝的质量之比为24g:27g=8:9,
故选D.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g) + I2(g)![]() 2HI(g) + Q (Q > 0)在一带有活塞的密闭容器中达到平衡,下列说法错误的是 ( )
2HI(g) + Q (Q > 0)在一带有活塞的密闭容器中达到平衡,下列说法错误的是 ( )
A.恒容,升高温度,正反应速率减小B.恒容,充入H2(g),I2(g)的体积分数降低
C.恒压,充入He(g),逆反应速率减小D.恒温,压缩体积,平衡不移动,混合气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
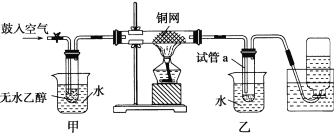
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是______反应。
(2)甲和乙两个水浴作用不相同,甲的作用是_________;乙的作用是:________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____。集气瓶中收集到的气体的主要成分是______。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Zn、Fe、Mg、Al四种金属中两种组成的20 g混合物与足量的盐酸反应产生2.0 g H2,则混合物中一定含有的金属是( )
A. ZnB. FeC. AlD. Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的比较中不正确的是( )
A.二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠
B.二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠
C.二者都能与盐酸反应放出二氧化碳气体,等质量时生成CO2量一样多
D.二者在一定条件下可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.1/2H2(g)+1/2Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.31g白磷晶体中含有P-P键数是NA
B.22.4LSO2含有NA个SO2分子
C.标准状况下,等质量的NO2和N2O4所含有原子个数相等
D.1molCl2通入热的NaOH溶液中(产物是NaCl、NaClO3),充分反应后转移的电子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
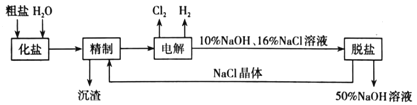
依据上图,完成下列填空:
(1)从海水中获取粗盐的方法是___。
(2)“精制”工序中,欲除去粗盐水中的Ca2+、Mg2+及SO42-,可进行的操作有:
A. 过滤
B. 加过量BaCl2溶液
C. 加适量稀盐酸
D. 加过量NaOH溶液
E. 加过量Na2CO3溶液
①正确操作的顺序是___(填字母)。
②操作B的目的是___
③操作C的目的是___
④操作D中发生反应的离子方程式是___
⑤此操作中的稀盐酸能否用稀硝酸代替?____(填“能”或“否”),理由是___。
(3)检验“电解”后的溶液中仍然含有NaCl的方法是___,观察到的现象是___。
(4)“脱盐“工序中,通过加热浓缩、冷却结晶、___的方法除去NaCl,该方法的原理是相同温度下NaCl与NaOH的溶解度不同,在该操作温度下,溶解度较大的是___。
(5)上述工艺中可循环使用的物质是______。(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com