
【题目】某些共价键的键长数据如下表所示。试根据下表回答问题。
共价键 |
|
|
|
|
|
|
|
|
键长 | 0.154 | 0.134 | 0.121 | 0.143 | 0.123 | 0.146 | 0.122 | 0.110 |
(1)根据表中有关数据,你能推断出影响共价键键长的因素主要有哪些?_______。其影响的结果怎样?__________。
(2)通常,键能越__________,共价键越____,由该键构成的分子越稳定。
【答案】原子半径、原子间形成共用电子对的数目 形成相同数目的共用电子对、原子半径越小,共价键的键长越短;原子半径相同、形成共用电子对的数目越多,键长越短 大 稳定
【解析】
同是单键、双键、三键时,原子半径越小,共价键的键长越短;相同原子间单键的键长大于双键的键长大于三键的键长。
(1)根据表中数据,分析规律可知,影响因素主要是原子半径和成键类型,其原子半径、原子间形成共用电子对的数目形成相同数目的共用电子对,原子半径越小共价键的键长越短;故答案为:原子半径、原子间形成共用电子对的数目;形成相同数目的共用电子对、原子半径越小,共价键的键长越短;原子半径相同、形成共用电子对的数目越多,键长越短;
(2)键长越短,共价键不易断裂,则键能越大,形成的分子也更稳定;故答案为:大;稳定。


科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种粒子中,半径按由大到小顺序排列的是( )
①基态X的原子结构示意图为
②基态Y的价电子排布式为![]()
③基态Z2-的轨道表示式为![]()
④基态原子W有2个电子层,电子式为![]()
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分等电子体类型、代表物质及对应的空间构型如表所示:
等电子类型 | 代表物质 | 空间构型 |
四原子24电子等电子体 | SO3 | 平面三角形 |
四原子26电子等电子体 | SO32- | 三角锥形 |
五原子32电子等电子体 | CCl4 | 四面体形 |
六原子40电子等电子体 | PCl5 | 三角双锥形 |
七原子48电子等电子体 | SF6 | 八面体形 |
请回答下列问题。
(1)请写出下列离子的空间构型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子构成,与F2互为等电子体的离子是__________。
(3)![]() 的空间构型如图1所示,请再按照图1的表示方法在图2中表示出
的空间构型如图1所示,请再按照图1的表示方法在图2中表示出![]() 分子中O、S、F原子的空间位置。已知
分子中O、S、F原子的空间位置。已知![]() 分子中O、S间为共价双键,S、F间为共价单键。__________。
分子中O、S间为共价双键,S、F间为共价单键。__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 键和
键和![]() 键的理解不正确的是
键的理解不正确的是![]()
A. ![]() 键可以绕键轴旋转,
键可以绕键轴旋转,![]() 键不能绕键轴旋转
键不能绕键轴旋转
B. ![]() 分子中的
分子中的![]() 键是
键是![]()
![]() 键,HClO分子中的
键,HClO分子中的![]() 键都是
键都是![]()
![]() 键
键
C. ![]() 分子和
分子和![]() 中都是含有5个
中都是含有5个![]() 键
键
D. ![]() 键以“头碰头”方式重叠,
键以“头碰头”方式重叠,![]() 键以“肩并肩”方式重叠
键以“肩并肩”方式重叠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盐酸中加入少量K2FeO4固体,产生黄绿色气体。该反应的化学方程式是___。
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___。
(3)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:___。
(4)Cl2与热的NaOH溶液反应生成NaClO3,该反应的离子方程式为___。
(5)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,写出该反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体采取面心立方最密堆积。设金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。则下列说法错误的是( )
A.金晶体每个晶胞中含有4个金原子
B.金属键无方向性,金属原子尽可能采取紧密堆积
C.一个晶胞的体积是![]()
D.金晶体的密度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇在保健品领域有广泛的应用。其合成路线如下:
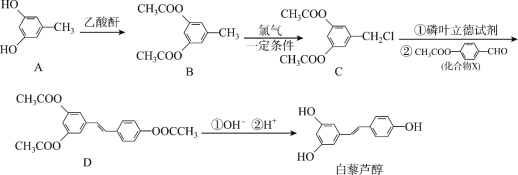
回答下列问题:
(1)物质B中含氧官能团的名_______。B→C的反应类型为___________。
(2)1mol有机物D最多能消耗NaOH为 _________mol,白藜芦醇遇足量浓溴水时反应的化学方程式为____________。
(3)已知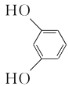 的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(
的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(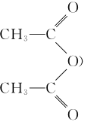 )极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
)极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
(4)C的核磁共振氢谱有_________组峰,写出满足下列条件的化合物X的所有同分异构体的结构简式__________。
①具有与X相同的官能团②属于醋酸酯
(5)利用甲苯、磷叶立德试剂和乙醛为原料可以合成![]() (涉及无机试剂自选),请写出合成路线__________。
(涉及无机试剂自选),请写出合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com