
【题目】合成氯是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) 2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)N2(g) + 3H2(g) 的平衡常数K=___(mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
【答案】0.075mol/(L·h)20%69.12C D2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=+1530kJ·mol-1
【解析】
(1)①由图表数据,结合V=△c/△t计算v(N2)的反应速率;
②依据化学平衡三段式列式计算转化率和平衡常数;
③达到平衡后,NH3的浓度与上表中相同,说明反应达到相同的平衡状态,将ABCD选项中转化为起始量后分别和表中的平衡对比分析;
(2)依据热化学方程式N2(g)+3H2(g)![]() 2NH3(g)△H=-93.0kJ·mol-1,书写氢气的燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l)△H=-285.6KJ·mol-1,结合盖斯定律计算得到所需热化学方程式;
2NH3(g)△H=-93.0kJ·mol-1,书写氢气的燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(l)△H=-285.6KJ·mol-1,结合盖斯定律计算得到所需热化学方程式;
(1)①图表数据中2h氮气的物质的量变化为2.0mol-1.7mol=0.3mol,0~2h内,v(N2)=![]() =0.075mol·L-1·h-1;
=0.075mol·L-1·h-1;
②3h反应达到平衡状态,依据化学平衡的三段式列式计算:反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数是反应N2(g)+3H2(g)
N2(g)+3H2(g)的平衡常数是反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数的倒数;
2NH3(g)的平衡常数的倒数;
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 2.0 6.0 0
变化量(mol) 0.4 1.2 0.8
平衡量(mol) 1.6 4.8 0.8
氢气的转化率=1.2mol/6.0mol×100%=20%
平衡常数K= =2/138.24;
=2/138.24;
反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数=1/K=138.24/2=69.12;
N2(g)+3H2(g)的平衡常数=1/K=138.24/2=69.12;
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同说明达到相同的平衡状态
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 2.0 6.0 0
A、a=l、b=3、c=0,起始量是原来的一半,压强减小说明平衡逆向进行,氨气的浓度减小,故A不符合;
B、a=4、b=12、c=0,起始量是原来的一倍,压强增大说明平衡正向进行,氨气的浓度增大,故B不符合;
C、 a=0、b=0、c=4,转化为起始量为2mol氮气和6mol氢气,和表中起始量相同,达到相同平衡状态,故C符合;
D、a=l、b=3、c=2转化为起始量为为2mol氮气和6mol氢气,和表中起始量相同,达到相同平衡状态,故D符合;
故选C D;
(2)热化学方程式①N2(g)+3H2(g)![]() 2NH3(g)△H=-93.0kJ·mol-1,书写氢气的燃烧热的热化学方程式为②H2(g)+1/2O2(g)=H2O(l)△H=-285.6KJ·mol-1,结合盖斯定律计算(①-②×3)×2得到所需热化学方程式;2 N2(g)+6 H2O (l)=4 NH3(g)+3 O2 (g)△H=+1530 kJ·mol-1;
2NH3(g)△H=-93.0kJ·mol-1,书写氢气的燃烧热的热化学方程式为②H2(g)+1/2O2(g)=H2O(l)△H=-285.6KJ·mol-1,结合盖斯定律计算(①-②×3)×2得到所需热化学方程式;2 N2(g)+6 H2O (l)=4 NH3(g)+3 O2 (g)△H=+1530 kJ·mol-1;


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于硝化反应说法正确的是
A.硝化反应是酯化反应,属于取代反应类型
B.硝化反应中混合酸的配制是先加浓硫酸再加浓硝酸
C.甲苯硝化反应的产物只有一种
D.硝基苯的密度大于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年12月科学家发现了迄今为止最轻的冰——“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构。下列有关叙述中不正确的是
A.冰的密度比液态水小B.冰与干冰由不同分子构成
C.“冰十六”可以包合气体分子D.液态水转变成“冰十六”是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的电离方程式书写正确的是( )
A. FeSO4=Fe3++SO42— B. Ca(OH)2=Ca2++2(OH)—
C. H2SO4= 2H++ SO42— D. KClO3=K++Cl—+O2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )又名草酸,是生物体的一种代谢产物;现设计如下实验探究草酸分解反应的产物。
)又名草酸,是生物体的一种代谢产物;现设计如下实验探究草酸分解反应的产物。
资料查阅:
Ⅰ.草酸熔点为102℃,150~160℃升华,157℃时开始分解。在人体中C2O42-容易与钙离子形成草酸钙导致肾结石。
Ⅱ.PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O====CO2+2HCl+Pd(黑色粉末)。
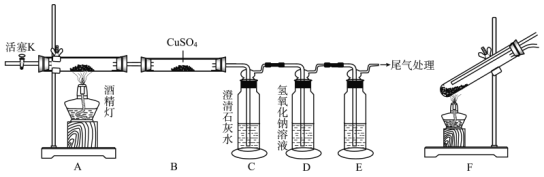
(1)A中盛放草酸的玻璃仪器的名称是_____________,实验中观察到B中CuSO4粉末变蓝,相关化学方程式为_____________。
(2)装置E中的试剂为_____________,当观察到_____________(填现象),可以证明有CO气体生成。
(3)下面是该实验过程中的相关操作,正确的操作顺序为_________(填入下列步骤的字母)。
A.向装置中通入适量N2 B.点燃酒精灯 C.检查装置气密性
D.装入相关试剂 E.再次通入N2并熄灭酒精灯
(4)为准确证眀A有CO2气体产生,需取少量C中沉淀于试管中,滴加过量盐酸并观察是否有气泡产生,其目的是_____________,草酸分解反应的化学方程式为_____________。
(5)实验过程中,学生提出装置A应改为装置F,请结合信息分析其原因是_____________;如果草酸粉末溅入眼睛里,应立即_____________,然后就医。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性无色溶液中能大量共存的离子组是的是
A. NH4+、Mg2+、SO42-、Cl-
B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl-
D. Na+ 、Ca2+、Cl -、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com