
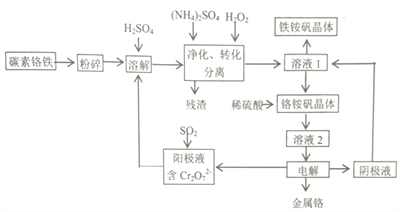
【题目】金属铬在工业上有广泛用途,主要用于不锈钢及高温合金的生产。铬铵矾(NH4Cr(SO4)2·12H2O)法是一种以碳素铬铁(主要是由Cr、Fe、C形成的合金)为主要原料生产金属铬,并能获得副产物铁铵矾【(NH4Cr(SO4)2·12H2O)】的方法。有关流程如下:
己知部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol/L):
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 4.9 |
完全沉淀的pH | 9.6 | 3.7 | 6.8 |
(1)溶解碳素铬铁前需将其粉碎,其目的是____________
(2)净化和转化阶段:所得残渣的主要成分是___________,转化时需要添加定量的H2O2,其目的是__________。由溶液1获得铁铵矾晶体的操作方法为______,过滤、洗涤、干燥。
(3)将铬铵矾晶体溶于稀硫酸,而不是直接溶于水的主要原因是_________________。
(4)阳极液通入SO2的离子反应方程式______________。
(5)工业废水中含有一定量的Cr3+,也含有一定量的Mg2+、Ca2+,而除去“钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF使两种沉淀共存时,溶液中c(Mg2+)/c(Ca2+)=__________。
(6)某课外活动小组将铬铵矾(NH4CrSO4)·12H2O)经过一系列操作获得了Cr2(CO3)3粗品。该小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为H2Y2-)测定粗品中Cr2(CO3)3的质量分数,准确称取2.00g粗品试样,溶于5.0mL稀盐酸中,依次加入5.0mLNH3·NH4Cl缓冲溶液、0.10g紫脲酸铵混合指示剂,用0.100mol/LEDTA标准溶液滴定至呈稳定颜色,平均消耗标准溶液5.00mL已知:Cr3++H2Y2-=CrY+2H+。
①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_____(填“偏大”、“偏小”或“不变”)。
②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=____。
【答案】 增大接触面积,提高反应速率 碳(或C) 使Fe2+转化为Fe3+ 蒸发浓缩,冷却结晶 抑制离子的水解 3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O 0.7 偏大 3.55%
【解析】(1)溶解碳素铬铁前需将其粉碎,增大接触面积,提高反应速率;(2)碳与双氧水、硫酸铵及硫酸均不反应,故净化和转化阶段:所得残渣的主要成分是碳(或C),转化时需要添加定量的H2O2,其目的是使Fe2+转化为Fe3+。由溶液1获得铁铵矾晶体的操作方法为蒸发浓缩,冷却结晶,过滤、洗涤、干燥;(3)将铬铵矾晶体溶于稀硫酸,而不是直接溶于水的主要原因是抑制离子的水解;(4)阳极液通入SO2,二氧化硫与Cr2O72-反应生成SO42-、Cr3+,反应的离子反应方程式为3SO2+Cr2O72-+2H+=3SO42-+2Cr3++H2O;(5) c(Mg2+)/c(Ca2+)= c(Mg2+)c2(F-)/c(Ca2+) c2(F-)= Ksp(MgF2)/ Ksp(CaF2)=![]() ;(6)①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,消耗的标准溶液计数偏大,则测定结果将偏大;②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=
;(6)①滴定操作中,如果滴定前装有EDIA标准溶液的满定管尖嘴部分有气泡,而滴定结束后气泡消失,消耗的标准溶液计数偏大,则测定结果将偏大;②粗品中Cr2(CO3)3的质量分数w[Cr2(CO3)3]=![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物Q是一种治疗关节炎的止痛药,合成Q的路线如下:

(1)A的名称为_______________。D中官能团的名称为_________________。
(2)E→F的反应类型为_______________。G→M的反应类型为_______________。
(3)B与(ClCH2CO)2O反应生成C和另一有机物H,该反应的化学方程式为_______________。
(4)有机物J为M的同分异构体。J有多种结构,写出满足下列条件的J的所有结构简式____________。
①苯环上只有两个取代基 ②能发生银镜反应
③核磁共振氢谱图中只有5组吸收峰,且峰面积之比为9:2:2:2:1
④酸性条件下能发生水解反应,且水解产物之一能与氧化铁溶液发生显色反应
(5)请写出以1-丙醇、苯、乙酸酐[(CH3CO)2O]为原料合成 的路线流程图(无机试剂任用,合成路线流程图示例见本题干):__________________________。
的路线流程图(无机试剂任用,合成路线流程图示例见本题干):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述不正确的是

A. HX的酸性比HY的弱,且HY是强酸
B. NaX溶液中存在关系:c(X-)+c(HX)=c(Na+)
C. 相同温度下,电离常数K(HX):a=b
D. ![]() ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)与化合物x、y、z有如图所示的转化关系,B与D同主族。下列说法正确的是

A. 化合物y阴阳离子个数比为1:1
B. 简单离子半径:D>C>B
C. 最高价氧化物对应的水化物的酸性:A>D
D. A与D形成的化合物AD2中各原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
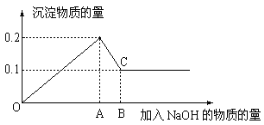
(1)图中C点表示当加入________mol NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 ____________。
(3)写出AB段发生反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
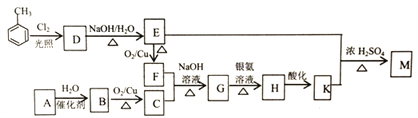
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂
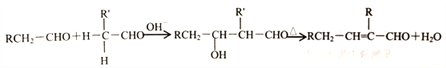
②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:
请回答下列问题:
(1)K的名称是_______;G中含有的官能团名称是_______ 。
(2)写出D→E的化学方程式_______ 。
(3)A-B的反应类型是_______;M的结构简式是_______ 。
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。
①遇FeCl溶液发生显色反应;
②能发生银镜反应;
③除苯环以外不再含有其他环状结构。
其中核磁共振氢谱为五组峰的结构简式为_______。
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,完善以下合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)______。
CH3CH2OH![]() CH3CHO
CH3CHO![]() ……
……![]() ……
……![]() CH3CH2CH=CH2
CH3CH2CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是( )
A. NaHCO3水解的离子方程式: ![]() + H2O
+ H2O![]()
![]() +H3O+
+H3O+
B. NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C. Al(OH)3的两性电离方程式:H++AlO2+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D. NaHSO3的电离方程式:NaHSO3![]() Na++
Na++![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com