
����Ŀ����������̼���º���{[Ni(CHZ)3](ClO4)2}��һ�����͵���ҩ��
��1��д����̬Niԭ�ӵ���Χ�����Ų�ͼ___��
��2��Ni����CO�γ������Ni(CO)4������CO���ṩ�µ��ӶԵ���Cԭ�Ӷ�����Oԭ�ӣ������ɿ�����___��1mol������������������ĿΪ___����NAΪ����٤��������ֵ����ͬ����
��3����ClO4-��VSEPRģ����___��
��д����ClO4-��Ϊ�ȵ������һ�ַ��ӣ�___(�ѧʽ)��
��4����������̼���º�����ѧʽ�е�CHZΪ̼���£���ṹΪ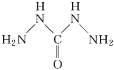 ������һ�����͵Ļ�����¯ˮ��������̼�����е�ԭ�Ӻ�̼ԭ�ӵ��ӻ�������ͷֱ�Ϊ___��___��
������һ�����͵Ļ�����¯ˮ��������̼�����е�ԭ�Ӻ�̼ԭ�ӵ��ӻ�������ͷֱ�Ϊ___��___��
��5����������̼���º�������NiO�������ἰ̼���»��϶��ɡ�
�ٸ����������ǿ�ڴ������ԭ����___��
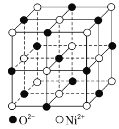
����ͼΪNiO������������Ni2+����λ��Ϊ___����������Ni2+���������O2-֮��ľ���Ϊapm����NiO������ܶ�=___g��cm-3���ú�a��NA�Ĵ���ʽ��ʾ����
���𰸡�![]() �縺��O��C��Oԭ�Ӳ����ṩ�µ��Ӷ� 8NA �������� CCl4 sp3 sp2 ���ǻ����ĸ���Խ�࣬Cl��������Խ�ߣ�����Cl��O��H��O�ĵ���Խ��Clƫ�ƣ�Խ�������H+ 6
�縺��O��C��Oԭ�Ӳ����ṩ�µ��Ӷ� 8NA �������� CCl4 sp3 sp2 ���ǻ����ĸ���Խ�࣬Cl��������Խ�ߣ�����Cl��O��H��O�ĵ���Խ��Clƫ�ƣ�Խ�������H+ 6 ![]()
��������
(1)NiԪ��ԭ�Ӻ�����28�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2��
(2)�縺��Խ��ԭ��Խ�����ṩ�µ��Ӷԣ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2��������
(3)��1molClO4����������4mol������
��ԭ��������ͬ���۲���Ӷ�������ȵ����ӻ�Ϊ�ȵ����壻
(4)̼�����е�ԭ����һ�Թµ��Ӷ����γ�3��������̼ԭ���γ�3��������
(5)�ٷ��ǻ�����ĿԽ�࣬����Ԫ�ص�������Խ�ߣ�Խ����������ӣ�
���Զ���Ni2+Ϊ���գ�����Χ�Ⱦ�������������Ӵ������ģ���Ni2+���������O2��֮��ľ���ɼ��㾧���������ɾ����������㾧�����V���ɾ�̯�����㾧����Ni2+��O2������Ŀ���ɼ��㾧������m�����ݾ����ܶ�����![]() ���㡣
���㡣
(1)NiԪ��ԭ�Ӻ�����28�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2����Χ�����Ų�ͼΪ![]() ��
��
(2)�縺��O��C��Oԭ�Ӳ������µ��Ӷԣ�����CO���ṩ�µ��ӶԵ���Cԭ�ӡ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2����������Ni(CO)4�к���8��������8��������1 mol �������������� ����ĿΪ8NA��
(3)��1molClO4����������4mol���������ӻ���ʽΪsp3��VSEPR ģ�����������壻
��ԭ��������ͬ���۲���Ӷ�������ȵ����ӻ�Ϊ�ȵ����壬1molClO4��������5molԭ�ӣ��۵���Ϊ32����ȵ�����ΪCCl4��SiF4�ȣ�
(4)̼�����е�ԭ����һ�Թµ��Ӷԣ�ÿ��Nԭ���γ�3�����������ӻ���ʽΪsp3��̼ԭ���γ�3���������ӻ���ʽΪsp2��
(5)��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����Cl��O��H��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+������Խǿ��
���Զ���Ni2+Ϊ���գ�����Χ�Ⱦ�������������Ӵ������ģ���֪Ni2+����λ��Ϊ3��8��![]() ��6����������Ni2+���������O2��֮��ľ���Ϊa pm��������Ϊ2a pm��2a��10��10cm���������V��(2a��10��10)3cm3��������Ni2+��ĿΪ8��
��6����������Ni2+���������O2��֮��ľ���Ϊa pm��������Ϊ2a pm��2a��10��10cm���������V��(2a��10��10)3cm3��������Ni2+��ĿΪ8��![]() +4��
+4��![]() ��4��O2����ĿΪ12��
��4��O2����ĿΪ12��![]() +1��4����������m��
+1��4����������m��![]() ���ʾ����ܶ�����
���ʾ����ܶ�����![]() ��
��![]() gcm��3��
gcm��3��


 ���ſ����ϵ�д�
���ſ����ϵ�д� ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H8O3���л�������NaHCO3��Һ��Ӧ��0.1 mol���л��������������Ʒ�Ӧʱ�����ռ�������µ�����2.24 L������������������л�����(�����������칹)
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֬����Ҫ��Ӫ�����ʣ�ij��Ȼ��֬A�ɷ������з�Ӧ��
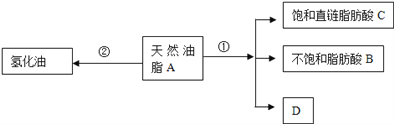
��֪��A�ķ���ʽΪC57H106O6��1mol����Ȼ��֬A����Ӧ�ٿɵõ�1molD��1mol������֬����B��2molֱ������֬����C�����ⶨB����Է�������Ϊ280��ԭ�Ӹ�����ΪC��H��O=9��16��1��
��1��д��B�ķ���ʽ��________________________��
��2��д����Ӧ�ٵķ�Ӧ���ͣ�____________��C������(���׳�)��_________��
��3�����գ�����ý��������⻯��Σ������ɱ������ı���������Ȼ����Ӧ��Ϊ��Ȼ��֬���⻯���̣������й�˵������ȷ����_______________��
a���⻯���ֳ��������ͣ�ͨ���ֽ�Ӳ���ͣ�
b��ֲ���;����⻯��������������Ʒ��ʽ֬��������������������⻯�ͣ�������Ѫ�ܶ���������Ѫ�ܼ�����
c���⻯�͵��Ʊ�ԭ�����ڼ���ֲ����ʱ���������������ͨ��������ʹҺ̬��֬��Ϊ���̬���̬��֬��
d����֬���⻯����֬�����������ڼӳɷ�Ӧ
��4��D�����������Ʒ�Ӧ�Ļ�ѧ����ʽ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������壨FeC2O4-2H2O��M=180g.mol-1��Ϊ����ɫ���壬������ˮ�������������������������﮵�ԭ�ϡ��ش��������⣺
ʵ��1̽�����������������ȷֽ����
��1���������ɷֵ�̽�����������װ�ã����ظ�ѡ�ã�����ʵ�飺
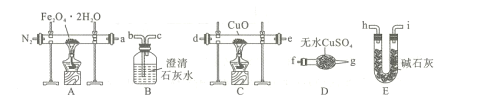
��װ��B������Ϊ ____��
�ڰ������������ҵķ�������װ�õ�����˳��Ϊa��___ ����ȼ���������ӿڵ���ĸ��ţ���
��Ϊ���ž�װ���еĿ�������ֹ����ʱ������ը��ʵ��ǰӦ���еIJ�����____��
��C�������ɺڱ�죬���ij���ʯ��ˮ����ǣ���֤����������к���____��
��2���������ɷֵ�̽�����������ȷֽ��ֺ�A��������ɫ���塣��ɫ���������Fe��FeO�����ʵ��֤����ɷ�ΪFeO�IJ���������Ϊ____��
��3�����ݣ�1���ͣ�2�����ۣ�A��������Ӧ�Ļ�ѧ����ʽΪ____��
ʵ��2��������������Ʒ���ȵIJⶨ
��ҵ�ƵõIJ������������г�����FeSO4���ʣ��ⶨ�䴿�ȵ���������ͼ��

��4���������������ܽ��ữ��KMnO4��Һ�ζ����յ�����ӷ���ʽΪ____��
��5����������������Ʒ�Ĵ���Ϊ ____���ô���ʽ��ʾ������������ҺʱFe2+����������ⶨ�����____������ƫ������ƫ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��P��Q��M��ԭ��������������Ķ�����Ԫ�أ�a��b��c��d�ֱ�����4��Ԫ�صĵ��ʣ��ס��ҡ��������ֱ�������ЩԪ����ɵĻ������֪��Q�ǵؿ��к�����ߵĽ���Ԫ�أ������Һ��ͨ������壬������ɫ����������������ˮ����Һ�ʼ��ԡ�����֮���ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
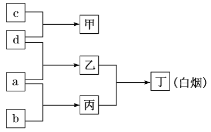
A.Ԫ�طǽ����ԣ�M��W��P
B.���Ǻ��й��ۼ������ӻ�����
C.P���������ˮ����һ����ǿ��
D.�ס��ҡ����������ֻ������������ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)�ǹ㷺������ҵ����������ӽṹ������ͼ��ʾ�������£�S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ���ҷ�Ӧ����������ʹƷ����ɫ�����塣����˵���������

A. S2Cl2�ķ����е�����Sԭ�Ӿ���sp3�ӻ�
B. S2Br2��S2Cl2�ṹ���ƣ��۷е㣺S2Br2 > S2Cl2
C. S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ��2S2Cl2+2H2O = SO2��+3S��+4HCl
D. S2Cl2�����е�SΪ+1�ۣ��Ǻ��м��Լ��ͷǼ��Լ��ķǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԪ�����ڱ�ǰ�����ڵ�Ԫ�ء�����XΪ�γɵĻ���������������Ԫ�أ�Y���ڲ��������������������9����Z��Ԫ�����ڱ��ĸ�Ԫ���е縺�����WԪ�صĵ������Ӳ㴦��ȫ����״̬�ҵ��ĵ��Ӳ�ֻ��2�����ӡ���ش��������⣮

��1��WԪ����Ԫ�����ڱ��е�λ��Ϊ____________________________��
��2���Ƚ�XZ4��YZ2���۷е��С��˵������________________________��
��3��W2+���백�������γ�������[W(NH3)4]2+��д���������ӵĽṹ��ʽ(������λ��)__��
��4��X�����⡢����������Ԫ�ع��ɻ�����XO(NH2)2������Xԭ�ӵ��ӻ���ʽΪ__��1mol��������������ĿΪ__������������ˮ����Ҫԭ����_______________________��
��5��X��ij�־���Ϊ��״�ṹ���������ڽ��������á���ԭ������ڸ���֮�䣬�γɼ�϶������䳣���ṹ��ƽ��ͶӰ��ͼ����ʾ�����仯ѧʽʱ��ʾΪ_________��
��6��Ԫ��Y��Ԫ��Z�γɵľ���ṹ��ͼ����ʾ��������Y���ӵ���λ��Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú���������в��ֲ��װ��(�г�װ������)��ͼ��ʾ������˵������ȷ����
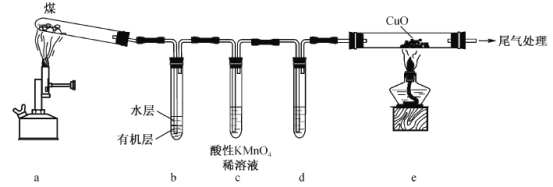
A.ú�ĸ�����̷������ӵ���������ѧ�仯
B.��bװ�õ�ˮ���е�����ɫʯ����Һ����Һ����
C.cװ�ÿɼ��������������һ������H2S
D.eװ���в����������ǹ����ɺ�ɫ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2CO3 �� H2C2O4 ���Ƕ�Ԫ���ᣬ��ͬ pH ���������Dz�ͬ��̬�����ӵ���ɰٷ�����ͼ��ʾ��

����˵����ȷ����
A. �� pH Ϊ 6.37 �� 10.25 ʱ����Һ�� c(H2CO3)��c(HCO3��)��c(CO32��)
B. ��Ӧ HCO3����H2O![]() H2CO3��OH����ƽ�ⳣ��Ϊ 10��7.63
H2CO3��OH����ƽ�ⳣ��Ϊ 10��7.63
C. 0.1 molL��1 NaHC2O4 ��Һ�� c(HC2O4��)��2c(C2O42��)��c(H2C2O4) ��0.1 molL��1
D. �� Na2CO3 ��Һ�м�������������Һ��������Ӧ��CO32����H2C2O4��HCO3����HC2O4-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com