
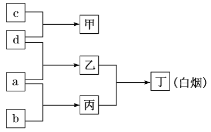
【题目】W、P、Q、M是原子序数依次增大的短周期元素,a、b、c、d分别是这4种元素的单质,甲、乙、丙、丁分别是由这些元素组成的化合物。已知:Q是地壳中含量最高的金属元素;向甲的溶液中通入丙气体,产生白色沉淀;丙气体溶于水,溶液呈碱性。它们之间的转化关系如图所示。下列说法正确的是( )
A.元素非金属性:M>W>P
B.丁是含有共价键的离子化合物
C.P的氧化物的水化物一定是强酸
D.甲、乙、丙、丁四种化合物均能抑制水的电离
【答案】B
【解析】
W、P、Q、M 是原子序数依次增大的短周期元素,a、b、c、d 分别是这4 种元素的单质,甲、乙、丙、丁分别是由这些元素组成的化合物,Q 是地壳中含量最高的金属元素,应为Al;向甲的溶液中通入丙气体,产生白色沉淀;丙气体溶于水,溶液呈碱性,应为NH3,则甲为AlCl3,c为Al,d为Cl2,丁为白烟,应为NH4Cl,可知乙为HCl,a为H2,b为N2,丙为NH3,则W为H元素,P为N元素,Q为Al元素,M为Cl元素,以此解答该题。
A.NH3中N为﹣3价,H为+1价,可知非金属性N>H,故A错误;
B.丁为NH4Cl,含有共价键和离子键,为离子化合物,故B正确;
C.P为N元素,对应的酸可为硝酸、亚硝酸等,亚硝酸为弱酸,故C错误;
D.丁为NH4Cl,水解呈酸性,可促进水的电离,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是

A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]()
![]() 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液![]() ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
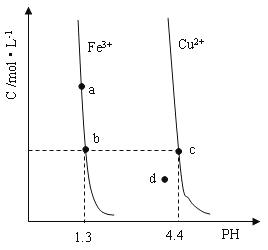
A.![]()
B.加适量![]() 固体可使溶液由
固体可使溶液由![]() 点变到
点变到![]() 点
点
C.![]()
![]() 两点代表的溶液中
两点代表的溶液中![]() 与
与![]() 乘积相等
乘积相等
D.![]() 、
、![]() 分别在
分别在![]() 、
、![]() 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:![]() ;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
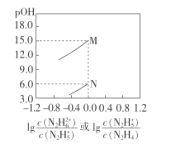
A.曲线M表示pOH与1g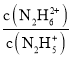 的变化关系
的变化关系
B.反应![]() 的
的![]()
C.pOH1>pOH2
D.N2H5Cl的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3、KAl(SO4)2·12H2O等可作净水剂,原因是_____________、__________________(离子方程式和文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)写出基态Ni原子的外围电子排布图___。
(2)Ni能与CO形成配合物Ni(CO)4,配体CO中提供孤电子对的是C原子而不是O原子,其理由可能是___;1mol该配合物分子中σ键数目为___(设NA为阿伏伽德罗常数的值,下同)。
(3)①ClO4-的VSEPR模型是___。
②写出与ClO4-互为等电子体的一种分子:___(填化学式)。
(4)高氯酸三碳酰肼合镍化学式中的CHZ为碳酰肼,其结构为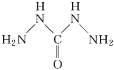 ,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为___、___。
,它是一种新型的环保锅炉水除氧剂。碳酰肼中氮原子和碳原子的杂化轨道类型分别为___、___。
(5)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①高氯酸的酸性强于次氯酸的原因是___。
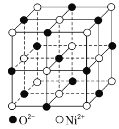
②如图为NiO晶胞,则晶体中Ni2+的配位数为___;若晶胞中Ni2+距离最近的O2-之间的距离为apm,则NiO晶体的密度=___g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:

(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)![]() 3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A. 用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B. 2 min时A、B、C三种气体的总量为5mol
C. 2 min时B的转化率为20%
D. 若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com