
����Ŀ�������۵���ߵĽ���������Ҫ��ս�����ʡ���Ȼ��������Ҫ�����ں��ٿ��У�����Ҫ�ɷ��������̵�������(FeWO4��MnWO4)����������Si��As�Ļ�����ɺ��ٿ�ұ���ٵĹ���������ͼ1��
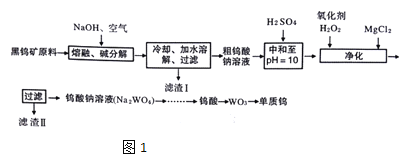
��֪��
������I����Ҫ�ɷ���Fe2O3��MnO2
�����������У��ٵĻ��ϼ�ֻ�������һ�������ı䡣
�۳���������������ˮ��
��1��������(FeWO4��MnWO4)����Ԫ�صĻ��ϼ�Ϊ___����д��MnWO4�����������·�����ֽⷴӦ����Fe2O3�Ļ�ѧ����ʽ___
��2�����������������������Һ�м������к���pH=10����Һ�е�����������ȷSiO32-��HAsO32-��HAsO42-�ȣ����������������У�����H2O2ʱ������Ӧ�����ӷ���ʽΪ___�����������Ҫ�ɷ���___
��3����֪�������ƺ������(CaWO4)�����ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С��ͼ2Ϊ��ͬ�¶���Ca(OH)2��CaWO4�ij����ܽ�ƽ�����ߣ���
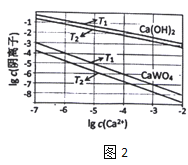
��T1___T2(����>������<��)T1ʱKsp(CaWO4)=___
�ڽ���������Һ����ʯ����õ���������ƣ�������Ӧ�����ӷ���ʽΪ___��
���𰸡�+6 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O H2O2+HAsO32-=HAsO42-+H2O MgSiO3��MgHAsO4 < 1��10-10 WO42-+Ca(OH)2=CaWO4+2OH-
2Fe2O3+4Na2WO4+4H2O H2O2+HAsO32-=HAsO42-+H2O MgSiO3��MgHAsO4 < 1��10-10 WO42-+Ca(OH)2=CaWO4+2OH-
��������
���ٿ�����Ҫ�ɷ���FeWO4��MnWO4��������Si��As�Ļ�������ڡ���ֽ�ɷ���������Ӧ��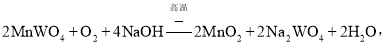
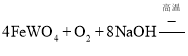
![]() ��ȴ��ˮ�ܽ���ˣ�����1Ϊ��Ҫ�ɷ���Fe2O3��MnO2���õ��Ĵ���������Һ�������к���pH=10����������⣬��
��ȴ��ˮ�ܽ���ˣ�����1Ϊ��Ҫ�ɷ���Fe2O3��MnO2���õ��Ĵ���������Һ�������к���pH=10����������⣬��![]() ����Ϊ
����Ϊ![]() �����ӷ���ʽΪ��
�����ӷ���ʽΪ��![]() �������Ȼ�þ������������ˮ��
�������Ȼ�þ������������ˮ��![]() ��
��![]() �����ˣ�������Ϊ��
�����ˣ�������Ϊ��![]() ��
��![]() ��
��
![]() ������
������![]() ��
��![]() ����Ԫ�ء���Ԫ�ػ��ϼ�Ϊ
����Ԫ�ء���Ԫ�ػ��ϼ�Ϊ![]() �ۣ���Ԫ��
�ۣ���Ԫ��![]() �ۣ��������л��ϼ۴�����Ϊ0������Ԫ�صĻ��ϼ�Ϊ
�ۣ��������л��ϼ۴�����Ϊ0������Ԫ�صĻ��ϼ�Ϊ![]() �����ٿ����Ҫ�ɷ��������̵������Σ���������ͼ����ʾ֪�����ٿ��ڿ�������������
�����ٿ����Ҫ�ɷ��������̵������Σ���������ͼ����ʾ֪�����ٿ��ڿ�������������![]() ��
��![]() ����
����![]() �ȣ���ѧ��Ӧ����ʽΪ
�ȣ���ѧ��Ӧ����ʽΪ ��
��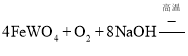
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��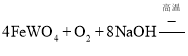
![]() ��
��
![]() ����������⣬
����������⣬![]() ����Ϊ
����Ϊ![]() �����ӷ���ʽΪ��
�����ӷ���ʽΪ��![]() �������Ȼ�þ������������ˮ��
�������Ȼ�þ������������ˮ��![]() ��
��![]() �����ˣ�������Ϊ��
�����ˣ�������Ϊ��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��
��
![]() ����ͼ���֪���������ƺ������
����ͼ���֪���������ƺ������![]() �ڸ�����Ũ����ͬʱ��
�ڸ�����Ũ����ͬʱ��![]() �¶���������Ũ�ȴ���
�¶���������Ũ�ȴ���![]() ��˵��
��˵��![]() ʱ���ܶȻ�����
ʱ���ܶȻ�����![]() ���ܶȻ�Խ�����ܽ��Խ������
���ܶȻ�Խ�����ܽ��Խ������![]() ʱ�ܽ�Ƚϴ���������֪�������ƺ������
ʱ�ܽ�Ƚϴ���������֪�������ƺ������![]() �����ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С������
�����ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С������![]() ��
��![]() ʱ
ʱ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
![]() ����������Һ����ʯ���飬�������ֽⷴӦ���������ƺ���������ӷ�Ӧ��������Ƴ�������Ӧ�����ӷ���ʽΪ��
����������Һ����ʯ���飬�������ֽⷴӦ���������ƺ���������ӷ�Ӧ��������Ƴ�������Ӧ�����ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֮Ϊ������ء���ֽ�ʵ�أ������ܷ�ӦΪZn+2MnO2+H2O![]() ZnO+2MnO(OH)������˵����ȷ����( )
ZnO+2MnO(OH)������˵����ȷ����( )
A���õ�ص�����Ϊп
B���õ�ط�Ӧ�ж����������������
C����65 g Zn��ȫ�ܽ�ʱ�������缫�ĵ���Ϊ1mol
D�����������ӦʽΪ2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���谢���ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A.![]() ������
������![]() �����Ƴ�ַ�Ӧ��ת�Ƶĵ�����Ϊ
�����Ƴ�ַ�Ӧ��ת�Ƶĵ�����Ϊ![]()
B.����ʱ��![]() ͭ��������Ũ���ᷴӦ��ת�Ƶĵ�����Ϊ
ͭ��������Ũ���ᷴӦ��ת�Ƶĵ�����Ϊ![]()
C.��![]() �����
�����![]() ��Ϲ��գ�����һ������ķ�����Ϊ
��Ϲ��գ�����һ������ķ�����Ϊ![]()
D.![]() ��
��![]() ��Һ��
��Һ��![]() ����ĿС��
����ĿС��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʯβ������ȡNiSO4�ǽ���ҹ�����Դ�ѷ���һ����Ҫ;������֪�ù������£�
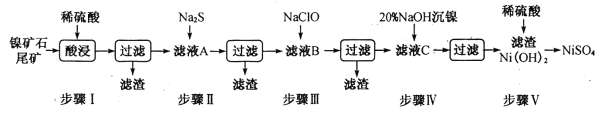
��1�������ʵ�Ksp�������±���
���� | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5��10-13 | 1.1��10-21 | 8.0��10-28 | 6.3��10-36 | 2.0��10-15 |
��2����ҺA�и��������ӵĺ������±���
�ɷ� | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | ���� |
����/g��L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | ���� |
����������Ϣ���ش��������⣺
(1)����I���֮ǰ�轫��ʯ���飬Ŀ����_______________��
(2)
(3)�����½��в�����Ŀ����Ϊ�˳�ȥ������Ԫ�أ���֪����Ԫ�ص����ӷ�Ӧ���£�2Fe2++ ClO - +5H2O=2Fe( OH)3��+Cl- +4H+����ʱMn2+����������ΪMnO2��д������Ԫ�ص����ӷ���ʽ_____________��
(4)����Ni(OH)2���������ӵ�ص���Ҫԭ�ϣ����ӵ�ع���ԭ�����£�Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2�������ŷŵ�Ľ��У�������pH______(����������������С������������)�����ʱ�����缫��ӦʽΪ______________________��
Cd(OH)2+2Ni(OH)2�������ŷŵ�Ľ��У�������pH______(����������������С������������)�����ʱ�����缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�����ֵ�������й�������ȷ����
Ϊ�����ӵ�����ֵ�������й�������ȷ����![]()
![]()
A.��⾫����ͭ![]() ����п��������
����п��������![]() ���������ܽ�32gͭ��ת�Ƶ�����ĿΪ
���������ܽ�32gͭ��ת�Ƶ�����ĿΪ![]()
B.![]() ���ӽṹ��ͼ
���ӽṹ��ͼ![]() ��
��![]() ����Ϊ
����Ϊ![]()

C.ij�¶��£�![]() ��
��![]() ��Һ�к��е�
��Һ�к��е�![]() ��ĿΪ
��ĿΪ![]()
D.����ȼ�ϵ����������![]() ����ʱ���������ĵ����������ĿΪ
����ʱ���������ĵ����������ĿΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���絼���Ǻ����������Һ����������С����������������Һ�絼�ʱ仯����ȷ���ζ���Ӧ���յ㡣��һ���¶��£��� 0.1 mol��L-1KOH��Һ�ֱ�ζ������Ϊ 20 mL��Ũ�Ⱦ�Ϊ 0.1 mol��L-1������ʹ�����Һ���ζ�������ͼ��ʾ�������й��ж���ȷ����
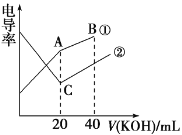
A.�ٱ�ʾ���� KOH��Һ�ζ�������Һ
B.A�����Һ����c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C.C ��ˮ����� c(OH-)С�� A ��ˮ����� c(OH-)
D.��B�����Һ���У�c(CH3COO-)��c(K+)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤����ʵ�����Ʊ��õ���Cl2�л����HCl����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش��������⡣

��1������ݼ�ͬѧ��ʾ��ͼ������ʵ��װ�ô������ҵ�����˳��װ�â���__________��
��2��װ�â�����Ҫ��������������__________��__________��__________��
��3��ʵ�����Ʊ�Cl2�����ӷ���ʽΪ____________��
��4��װ�â���Cu������__________���û�ѧ����ʽ��ʾ����
��5����ͬѧ��Ϊ��ͬѧʵ�������Ȼ����ȱ�ݣ�����֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ�ˣ���ͬѧ�������ͨ��װ�â�֮ǰ��Ҫ��װһ������װ�âݣ���֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�����Ϊװ�â�Ӧ����__________��
��6����ͬѧ������ͬѧ��Ƶ�װ�ú����������װ�ã�ֻ�轫ԭ���ձ��е�AgNO3��Һ������ɫʯ����Һ������۲쵽__________��������֤����Cl2ʱ��HCl�ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��õζ�����ȡһ�������Ũ��ˮ������ƿ�У���NaOH��Һ�Ժ㶨�ٶ����ζ���Ũ��ˮ�����ݲⶨ������Ƴ�ClO����ClO3�������ӵ����ʵ���Ũ��c��ʱ��t�Ĺ�ϵ�������¡�����˵����ȷ����( )

A.NaOH��Һ��Ũ��ˮ����ʹ��ͬ�ֵζ���ʢװ
B.a����Һ�д������¹�ϵ��c(Na+) + c(H+) = c(ClO��)+ c(OH��)+ c(ClO3��)
C.b����Һ�и�����Ũ�ȣ�c(Na+) > c(Cl��) > c(ClO��) = c(ClO3��)
D.t2~t4��ClO�������ʵ����½���ԭ�������ClO�������绯��2ClO��= Cl��+ ClO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵����������������������״����֮��Ĺ�ϵ��ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ���ǣ� ��

A. ��ʼʱ����������ΪH2
B. AB�η����ķ�ӦΪ�û���Ӧ
C. �μӷ�Ӧ���۵�������m2=5.6 g
D. ���û����Һ��c��HNO3��=0.5 molL��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com