
| A、1molCl2参加反应转移电子数一定为2NA |
| B、1L0.1mol?L-1氨水含有0.1 NA个OH- |
| C、10LpH=1的硫酸溶液中含有的H+离子数为NA |
| D、常温常温下,2.24L丁烷分子所含的C-H键数为NA |


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
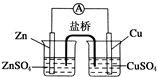 下列说法正确的是( )
下列说法正确的是( )| A、盐桥中的阴离子向硫酸铜溶液中迁移 |
| B、锌电极发生还原反应,铜电极发生氧化反应 |
| C、铜电极上发生的电极反应是2H++e-→H2↑ |
| D、电子从锌电极通过检流计流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Al3+)=0.1mol/L的溶液中:Na+、K+、[Al(OH)4]-、SO42- |
| B、使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- |
| C、由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
| D、加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图中的实验装置可用于制取乙炔.
图中的实验装置可用于制取乙炔.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com