
【题目】化学与生活密切相关。下列说法错误的是
A. 用白磷作包装食品的脱氧剂 B. 食品保鲜膜能减缓食品中水分的蒸发
C. 用液氨作制冷剂冷藏物品 D. 用臭氧对医疗器械进行消毒
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有_________,非电解质的有____________。(填序号)
(2)向⑦中逐滴滴加①的水溶液,看到的现象___________________________________。
(3)②在水溶液中的电离方程式为___________________________________。
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式________________________________。
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:_________________________。
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____。 (已知: ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手。
I.研究发现,NOx是雾霾的主要成分之一,NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50kJ·mol-1
2NO(g) △H=+180.50kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-566.00 kJ·mol-1
2CO2(g) △H=-566.00 kJ·mol-1
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环,写出该反应的热化学方程式 _____________。
II.开发利用清洁能源可减少污染,解决雾霾问题。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景,一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。
CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。

(1)该反应的反应热△H _______ 0(填“>”或“<”),压强的相对大小与P1______P2(填“>”或“<”)。
(2)该反应化学平衡常数表达式为___________。
(3)下列各项中,不能说明该反应已经达到平衡的是______________。
A.容器内气体压强不再变化 B.v(CO):v(H2):v(CH3OH)=1:2:1
C.容器内的密度不再变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
III.依据燃烧反应原理,合成的甲醇可以设计如图所示的燃料电池装置。

(5)负极电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【徐州市2017届考前模拟冲刺打靶卷】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g)![]() 2D(g) △H=Q kJ·mol–1。相关条件和数据见下表:
2D(g) △H=Q kJ·mol–1。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/ mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K 2 | K 3 |
下列说法正确的是
A.K 3>K 2=K 1
B.实验Ⅱ可能使用了催化剂
C.实验Ⅲ达平衡后容器内的压强是实验Ⅰ的![]() 倍
倍
D.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A. K+、Cu2+、NH4+、OH- B. Na+、SO42-、K+、Cl-
C. Na+、H+、Fe2+、NO3- D. Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列叙述中正确的是 ( )
A. 6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B. 在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C. 14 g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【淄博市2017届仿真模拟(打靶卷)】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是
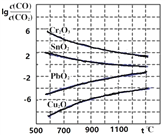
A.通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原PbO2的反应ΔH>0
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【衡水中学2017年高考押题卷】利用H2和O2制备H2O2的原理为
① H2(g)+ A(1)![]() B(1) ΔH1 ②O2(g)+B(1)
B(1) ΔH1 ②O2(g)+B(1)![]() A(1)+ H2O2(1) ΔH2
A(1)+ H2O2(1) ΔH2
巳知:A、B均为有机物,两个反应均能自发进行,下列说法正确的是
A.ΔH2>0
B.B为H2和O2制备H2O2的催化剂
C.反应①的正反应的活化能大于逆反应的活化能
D.H2(g)+O2(g)![]() H2O2(1) 的ΔH <0
H2O2(1) 的ΔH <0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com