
【题目】【衡水中学2017年高考押题卷】利用H2和O2制备H2O2的原理为
① H2(g)+ A(1)![]() B(1) ΔH1 ②O2(g)+B(1)
B(1) ΔH1 ②O2(g)+B(1)![]() A(1)+ H2O2(1) ΔH2
A(1)+ H2O2(1) ΔH2
巳知:A、B均为有机物,两个反应均能自发进行,下列说法正确的是
A.ΔH2>0
B.B为H2和O2制备H2O2的催化剂
C.反应①的正反应的活化能大于逆反应的活化能
D.H2(g)+O2(g)![]() H2O2(1) 的ΔH <0
H2O2(1) 的ΔH <0
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 用白磷作包装食品的脱氧剂 B. 食品保鲜膜能减缓食品中水分的蒸发
C. 用液氨作制冷剂冷藏物品 D. 用臭氧对医疗器械进行消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是 ( )
A. H2SO4+2NaOH=Na2SO4+2H2O B. CuO+H2![]() Cu+ H2O
Cu+ H2O
C. NH3+HCl=NH4Cl D. 2NaHCO3![]() Na2CO3+ H2O +CO2↑
Na2CO3+ H2O +CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
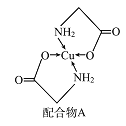


(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、SO![]() ,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO
,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中Ca2+、Mg2+、SO![]() 。提纯时的操作步骤和加入试剂的情况如图。
。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是
________________________________________________________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式为
________________________________________________________________________。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是________。

Ⅱ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的 ________(填序号),该仪器名称为________,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②氯水与KI溶液反应(写出离子方程式)_____________________________。
③苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是

A. 图中A、B、D三点处Kw的大小关系:B>A>D
B. 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C. 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D. A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下11.2 L的甲烷气体含有甲烷分子数为0.5 NA个
B. 14g乙烯和丙烯的混合物中总原子数为3 NA个
C. 0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA个
D. 5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com