
【题目】下列是MnO2工业制备及对含Mn2+废水处理的有关问题,已知:Ksp[Mn(OH)2]=1.9×10-13 , Ksp(MnCO3)=2.2×10-11,回答下列问题:
(1)用惰性电极电解MnSO4溶液可制备MnO2,其阳极反应式为___________。
(2)往MnSO4溶液中加入(NH4)2CO3溶液制取MnCO3时会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
(3)废水中的Mn2+,也可用NH4HSO4调节溶液的pH。室温时,往100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如下图所示 (反应前后溶液总体积变化忽略不计) 。
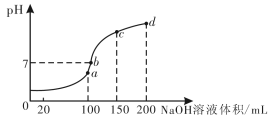
a点c(NH4+)+c(NH3 .H2O)=__________mol·L-1 ;图中a、b、c、d四个点,水的电离程度最大的是__________;b点,溶液中各离子浓度由大到小的排列顺序是____________________。
【答案】Mn2+-2e-+2H2O= MnO2+4H+ 115.8 或1.2×102 0.05 a点 c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
(1)阳极发生氧化反应,锰离子在阳极失电子化合价升高,生成二氧化锰,根据原子守恒,反应物中有H2O参加,再根据电荷守恒,生成物中还有H+,据此分析;
(2)由MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq),可知,
Mn(OH)2(s)+CO32-(aq),可知,
K=![]() =
=![]() ,据此计算;
,据此计算;
(3)NH4HSO4电离的H+抑制水的电离,NH4+水解促进水的电离,NH3![]() H2O电离出OH-,抑制水的电离;a点溶液溶质恰好为(NH4)2SO4与Na2SO4,溶液呈酸性;b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3
H2O电离出OH-,抑制水的电离;a点溶液溶质恰好为(NH4)2SO4与Na2SO4,溶液呈酸性;b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3![]() H2O,以此分析解答。
H2O,以此分析解答。
(1)阳极发生氧化反应,锰离子在阳极失电子化合价升高,生成二氧化锰,根据原子守恒,反应物中有H2O参加,再根据电荷守恒,生成物中还有H+,则反应的电极式为Mn2+-2e-+2H2O=MnO2+4H+;
因此,本题正确答案是:Mn2+-2e-+2H2O=MnO2+4H+;
(2)由MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq),可知,K=
Mn(OH)2(s)+CO32-(aq),可知,K=![]() =
=![]()
=![]() =115.8;
=115.8;
因此,本题正确答案是:115.8;
(3)a点溶液为0.1 mol/L的NH4HSO4溶液与0.1 mol/L NaOH溶液等体积混合,恰好消耗完H+,溶液中只有 (NH4)2SO4与Na2SO4,溶液体积增大一倍,根据物料守恒关系,c(NH4+)+c(NH3 .H2O)=0.1 mol/L ×![]() =0.05mol·L-1 ;
=0.05mol·L-1 ;
向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液;OH-先中和H+,在此过程中水的电离程度增大;后OH-与NH4+反应生成NH3·H2O,NH4+浓度减小,水解程度减小,则水的电离程度减小;b、c、d三点溶液均含有NH3 .H2O,NH3 .H2O抑制水的电离,a点恰好将H+完全中和,NH4+浓度最大,所以水的电离程度最大的是a点;
b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3![]() H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
因此,本题正确答案是:0.05; a点;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过计算填写下列内容:
(1)2.5mol CH4的质量是____________;标准状况下的体积为_______________。
(2)1.5NA个H3PO4含氧原子的物质的量为_________。
(3)12g某二价金属的硫酸盐中,含有0.1mol SO![]() ,该金属的相对原子质量为________。
,该金属的相对原子质量为________。
(4)实验测得CO、N2和O2等三种气体的混合气体的密度是H2的15.5倍,其中O2的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模仿植物的光合作用,开发出了利用太阳光、水及二氧化碳(CO2)合成甲烷(CH4)的人工光合系统,其工作原理如图所示。下列说法错误的是( )
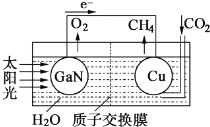
A. GaN为负极,Cu为正极 B. 该装置中只存在两种能量的转化
C. GaN电极的电极反应式为2H2O-4e-=4H++O2↑ D. 该装置工作时,H+向Cu电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水含大量的FeSO4,较多的Cu2+和少量的K+。某工厂计划回收金属铜并制取硫酸亚铁,流程如下图,相关分析错误的是( )

A.步骤①加入过量Fe粉后过滤,分别得到固体A和滤液B
B.步骤②所加试剂是稀盐酸
C.蒸发结晶时有大量晶体析出就停止加热
D.取少量步骤①所得溶液B于试管中,先加入盐酸酸化,再加入BaCl2溶液,有白色沉淀生成,表明溶液B中含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签“100mL 1.0molL-1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl-、H2O
B.若取 50mL 溶液,其中的 c(Cl-)=1 molL﹣1
C.取该溶液5.0 mL恰好与0.1 molL-1 AgNO3100 mL溶液完全反应
D.取10mL该溶液加水10 mL,所得MgCl2溶液的浓度为0.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算在0.2 g H2中含有____个H原子,2 mol CO(NH2)2中含___mol C,___mol N,___mol H,标准状况下,44.8 L O2的体积为___mol。
(2) 2.3 g Na中含___mol e-,在与足量水反应中产生标准状况下的H2___L。
(3) 0.4 mol Al2(SO4)3的溶液中,含__mol SO42—,Al3+物质的量__0.8 mol(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制480 mL 0.2mol/L NaOH溶液。具体如下:
(1)需______gNaOH。
(2)配制过程中,下列仪器不会用到的是__________(填序号),尚缺少的玻璃仪器是______________。
A.托盘天平 B.250mL容量瓶 C.玻璃棒 D.胶头滴管
(3)实验过程中两次用到玻璃棒,其作用分别是:______________、_________。
(4)定容操作:将蒸馏水注入所选的容器中,直到其中液面接近其刻度线____________处时,改用____________滴加蒸馏水至溶液的__________正好与刻度线_______。将瓶塞子盖好,反复____________摇匀。
(5)下列操作的正确顺序是(用字母表示)B→_____→________→______→__________→_____→G。
A.转移 B.称量 C.定容 D.洗涤 E.冷却 F.溶解 G.摇匀
II.乙同学用18.4mol/l浓硫酸配制100ml 3.6mol/L的稀硫酸。
用100 ml 量筒量取20 ml 浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 ml 刻度线,再搅拌均匀。
指出其中错误之处____________________________。
III.在配制一定物质的量浓度溶液时,下列操作出现的后果是(填:“偏低”.“偏高”.“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。_____________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水。______________。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度____________。
(4)转移时不慎将溶液倒在瓶外;____________;
(5)定容时俯视容量瓶刻度线:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com