
【题目】下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O ![]() 2OH—+Cl2↑+H2↑
2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O ![]() Cl- +ClO- +2H+
Cl- +ClO- +2H+
D. Na2S溶液中![]() 的水解:S2—+2H2O==H2S+2OH—
的水解:S2—+2H2O==H2S+2OH—
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法不正确的是
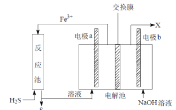
A.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
B.若交换膜为阳离子交换膜,b 电极区会产生红褐色沉淀
C.电极 a 为阳极
D.反应池中处理H2S的反应是H2S +2Fe3+ = 2Fe2+ +S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+CO(g)![]() CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同条件下,反应物2 mol H2和1 mol CO 的总能量一定高于生成物1 mol CH3OH(g)的总能量
D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为 CuCO3Cu(OH)2、CuSiO32H2O,含 SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
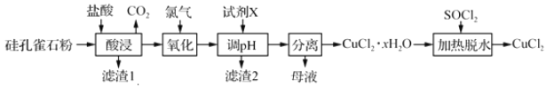
已知:SOCl2+H2O ![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为________________,为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③_________;
(2)滤渣2的主要成分为___________(填化学式);
(3)“氧化”时发生反应的离子方程式为__________________________;
(4)试剂X的作用是调节溶液的pH,试剂X可以是_____;“调pH”时,pH不能过高,其原因是_______________;
A.CuSO4 B.Cu2(OH)2CO3 C.NaOH D.CuO
(5)“加热脱水”时,加入SOCl2的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是__________________________。
(2)WX2的电子式是_______________________。
(3)R2X、R2Y中,稳定性较高的是____(填化学式),请从原子结构的角度解释其原因:_____。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是________(填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_____________。
(5)科研人员从矿石中分离出一种氧化物,化学式可表示为M2O3。为确定M元素的种类,进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,反应完全时,被M2O3氧化的Zn为0.06 mol;
综合以上信息推断,M可能位于元素周期表第_________________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定环境中,下列各组离子一定大量共存的是
A. 甲基橙呈红色的溶液中:K+、Na+、S2-、AlO2-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 常温下,在![]() = 1×1012的溶液中:NH4+、CO32-、K+、Cl-
= 1×1012的溶液中:NH4+、CO32-、K+、Cl-
D. 常温下,水电离出的c(OH—)=1×10—13 mol/L的溶液中:Na+、NH4+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的能量变化符合下图所示的是
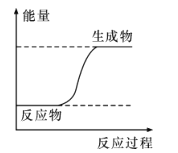
A. 酸碱中和反应
B. CH4在O2中燃烧
C. NH4Cl晶体与Ba(OH)28H2O晶体混合搅拌
D. CaO溶于水生成Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A. 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-)
B. pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 0.1mol·L-1HCl溶液与0.2 mol·L-1 NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D. 0.1mol·L-1K2C2O4溶液与0.2 mol·L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)+c(H2C2O4) ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
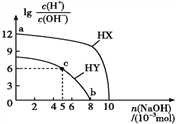
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com