
【题目】已知2H2(g)+CO(g)![]() CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同条件下,反应物2 mol H2和1 mol CO 的总能量一定高于生成物1 mol CH3OH(g)的总能量
D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )
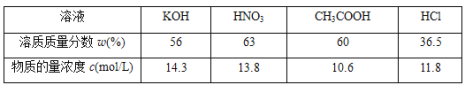
A.HClB.HNO3C.CH3COOHD.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁(C6H11O7) 2Fe是常用的补铁剂,易溶于水。用下图装置制备 FeCO3,提取出的 FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:

Ⅰ.(1)如何检验 A 装置的气密性?____。
(2)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、______,关闭_____,一段时间后,关闭_______,打开_____(填旋塞的编号)。
(3)将制得的碳酸亚铁悬浊液过滤、洗涤。如何证明沉淀已经洗涤干净_________。
(4)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为(有机物用分子式表示)_____。
(5)从环境保护的角度分析,该装置存在不足之处,请写出改正措施__________。
Ⅱ.某补铁剂的主要成分是硫酸亚铁,用氧化还原滴定法可测定该补铁剂中铁元素的含量,实验的主要步骤如下:
①取10片补铁剂样品,溶解除去不溶物(不损耗铁元素),并配成100mL待测溶液。
②量取20.00mL待测液于锥形瓶中。
③用cmol·L1的酸性KMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积,重复两次实验,平均消耗KMnO4溶液体积为VmL。
(6)上述实验中应该用稀硫酸酸化KMnO4溶液,如果用硝酸对KMnO4溶液进行酸化,对测定结果的影响是_____(填“偏大”“偏小”或“无影响”)。滴定终点的实验现象为_____。
(7)每片补铁剂含铁元素的质量为________________g(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
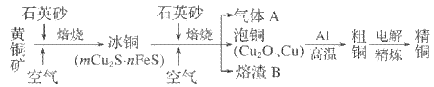
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的转化可用下图表示,且x,y,z都含有相同的一种元素。图示中有部分生成物未列出来
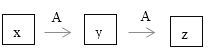
(1)①若x是AlCl3,则y的化学式是________________
②若x的阴离子含有铝元素,写出此阴离子与过量盐酸反应的离子方程式:___________________
(2)若x是一种黄绿色有毒单质气体,A是世界使用量最大的一种金属单质。
①写出A元素原子的电子排布式:__________________
②配制y的溶液,一般不是把Y的晶体溶于水,而是把y的晶体先溶解于_________(填化学式)溶液中。
③如何检验z物质中的阳离子:________________________________________________。
(3)①若x是能使湿润红色石蕊试纸变蓝的气体,该气体的中心原子轨道杂化类型是______________
②下列各组组合,不符合上图反应的是______________(填序号)
Ⅰ x: N2 A: O2 Ⅱ x: Al A: NaOH Ⅲ x: Ba(OH)2 A: CO2
Ⅳ x: S A: O2 Ⅴ x: HNO3 A: Fe Ⅵ x: SiO2 A: C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线________(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)3 min内,以X的浓度变化表示的平均反应速率为_____________。
(3)下列措施能使该反应速率加快的是________(用序号回答)。
①升高温度 ②减小容器体积 ③通入N2O4 ④通入Ar使压强增大 ⑤通入HCl气体
(4)下列叙述能说明该反应已达到化学平衡状态的是____________(填标号)。
A.容器内压强不再发生变化
B.混合气体的密度不变
C.容器内混合气体原子总数不变
D.混合气体的平均相对分子质量不变
E.v(NO2)=2v(N2O4)
F.相同时间内消耗n mol的Y的同时消耗2n mol的X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
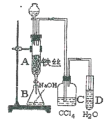
(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O ![]() 2OH—+Cl2↑+H2↑
2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O ![]() Cl- +ClO- +2H+
Cl- +ClO- +2H+
D. Na2S溶液中![]() 的水解:S2—+2H2O==H2S+2OH—
的水解:S2—+2H2O==H2S+2OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com