
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一刻SO2、O2、SO3浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,达到平衡时浓度可能是( )
2SO3(g),已知反应过程中某一刻SO2、O2、SO3浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,达到平衡时浓度可能是( )
A.SO2、O2分别为0.4mol/L、0.3mol/L
B.O2为0.05mol/L
C.SO2、SO3浓度均为0.15mol/L
D.SO2为0.24mol/L、SO3为0.16mol/L
【答案】D
【解析】
A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,根据硫原子的守恒当SO2的浓度为0.4mol/L时,则SO3的浓度为0,而可逆反应不能进行彻底,即无论进行多长时间,SO3的浓度均不可能为0,故A错误;
B.O2的浓度减小,说明反应向正反应方向进行建立平衡,若SO2完全反应,则消耗氧气的浓度为0.1 mol/L,剩余氧气浓度为0.1 mol/L,实际剩余氧气浓度为0.05mol/L小于0.1mol/L,故B错误;
C.反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;
D.SO2的浓度增大,说明该反应向正反应方向进行建立平衡,根据反应中的硫原子的守恒,SO2和SO3浓度和一定为0.4mol/L,而现SO2为0.24mol/L,SO3为0.16mol/L,满足硫原子的守恒,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
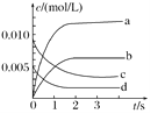
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.标准状况下,2.24LH2O分子中共价键的数目为0.2NA
B.1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C.N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
D.0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJmolˉ1
C.H2燃烧热为285.8kJmolˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
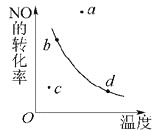
A.a点B.b点C.c点D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,固定容积的密闭容器中发生反应A(g)+3B(g)![]() 2C(g)+2D(s),下列叙述不是反应达到平衡状态标志的是( )
2C(g)+2D(s),下列叙述不是反应达到平衡状态标志的是( )
①2υ正(B)=3υ逆(C) ②单位时间内生成amol A,同时生成3amol B
③A、B、C的浓度不再变化 ④混合气体密度不随时间变化而变化
⑤混合气体的总压强不再变化 ⑥密闭容器中C的体积分数不变
⑦单位时间内消耗amol A,同时生成3amol B ⑧A、B、C、D的分子数之比为1∶3∶2∶2
A.②⑧B.②⑤⑧C.①③④⑦D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
(1)铁、钴、镍都是很好的配位化合物形成体.
①[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。写出Co2+的价层电子排布图__.[Co(H2O)6]2+中Co2+的配位数为__。NH3分子的中心原子杂化方式为__,H2O分子的立体构型为__。
②铁、镍易与一氧化碳作用形成羰基配合物,如:Fe(CO)5,Ni(CO)4等.CO与N2属于等电子体,则CO分子中σ键和π键数目比为__,写出与CO互为等电子体的一种阴离子的离子符号__。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价.NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO__FeO(选填“<”“>”“=”);某种天然NiO晶体存在如图所示缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性.某氧化镍样品组成为Ni0.97O.该晶体中Ni3+与Ni2+的离子数之比为__。
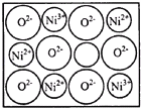
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为______________,P的基态原子价层电子排布式为__________________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___________________。
(3)M、O电负性大小顺序是__________(用元素符号表示),实验室制备O单质的化学方程式__________________________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的边长为 a pm,则该晶体的密度为____________________g/cm3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com