
����Ŀ�������ܡ���Ϊ�������ڵ�����Ԫ�أ����ǵ����ʷdz����ƣ�Ҳ��Ϊ��ϵԪ�أ�
��1�������ܡ������Ǻܺõ���λ�������γ��壮
��[Co��H2O��6]2+�ڹ�����ˮ����ת��Ϊ[Co��NH3��6]2+��д��Co2+�ļ۲�����Ų�ͼ__��[Co��H2O��6]2+��Co2+����λ��Ϊ__��NH3���ӵ�����ԭ���ӻ���ʽΪ__��H2O���ӵ����幹��Ϊ__��
������������һ����̼�����γ��ʻ������磺Fe��CO��5��Ni��CO��4�ȣ�CO��N2���ڵȵ����壬��CO������������������Ŀ��Ϊ__��д����CO��Ϊ�ȵ������һ�������ӵ����ӷ���__��
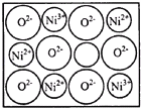
��2��+2�ۺ�+3����Fe��Co��Ni��Ԫ�س������ϼۣ�NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�NiO__FeO��ѡ����������������=������ij����ȻNiO���������ͼ��ʾȱ�ݣ�һ��Ni2+��ȱ����������Ni2+������Ni3+��ȡ�������������Գʵ����ԣ�ij��������Ʒ���ΪNi0.97O���þ�����Ni3+��Ni2+��������֮��Ϊ__��
���𰸡�![]() 6 sp3 V�� 1��2 CN�� �� 6��91
6 sp3 V�� 1��2 CN�� �� 6��91
��������
���ݹ���ԭ������ԭ�Ӻ����ӵĺ�������Ų���������������Ľṹ�ص��������λ�������ݼ۲���ӶԻ������۷���ԭ�ӵ��ӻ���ʽ�����ӵĿռ乹�ͣ����ݵȵ���ԭ�������ȵ�����ijɼ��ص㣻�����Ȼ��ƾ���Ľṹ�ص�͵��������е�������֮�ȡ�
��1����Co��27��Ԫ�أ����ݹ���ԭ����֪�����̬ԭ�ӵļ۵����Ų�ʽΪ3d74s2����ʧȥ������2�����Ӻ��ΪCo2+����Co2+�ļ۲�����Ų�ͼΪ![]() ��
��
[Co��H2O��6]2+��6��ˮ���������壬��Co2+����λ��Ϊ6��
NH3���ӵ�����ԭ��Nԭ�ӵļ۵��Ӷ���Ϊ![]() 4�������ӻ���ʽΪsp3��
4�������ӻ���ʽΪsp3��
H2O���ӵ�Oԭ�ӵ��ӻ���ʽҲ��sp3������Oԭ�ӻ���2���µ��Ӷԣ���Գɼ����ӶԵij����ϴ�ˮ���ӵ����幹��ΪV�Σ�
��CO��N2���ڵȵ����壬���ڵ������ӵĽṹʽΪN��N����CO���ӵĽṹʽΪC��O��������������������Ŀ��Ϊ1��2�����ݵȵ�������γ�������֪����CO��Ϊ�ȵ��������������CN����
��2������NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm��Ni2+�İ뾶��С����NiO�ľ����ܽϴ��۵�NiO��FeO�� NiO���������ͼ��ʾȱ�ݣ������侧���Գʵ����ԣ����������ΪNi0.97O����Ni3+��Ni2+����Ŀ�ֱ�Ϊ����0.97-x��3x+2(0.97-x)=12����֮�ã�x=0.06����þ�����Ni3+��Ni2+��������֮��Ϊ0.06:0.91=6:91��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)�۵�-54.1�桢�е�69.2�棬��Ⱦ�ϡ�ҩƷ�����ݼ���ũ��ɱ�������������������Ҫ���á�
(1)SO2Cl2��S�Ļ��ϼ�Ϊ_______��SO2Cl2�ڳ�ʪ��������ˮ�����������Ļ�ѧ����ʽΪ________________��
(2)�����ø����Cl2��SO2�ڻ���̿������ȡ�����ȣ�ʵ��װ����ͼ��ʾ(�г�װ��δ����)��
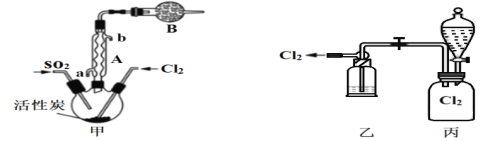
������A������Ϊ___________��װ������װ����Լ�_____________��װ��B��������_______________________��
��װ�ñ���Һ©����ʢװ������Լ���________(ѡ����ĸ)��
A.����ˮ B.10.0 mol/LŨ����
C.Ũ����������Һ D.����ʳ��ˮ
(3)̽���������ڴ��������¼��ȷֽ�IJ��ʵ��װ����ͼ��ʾ(���ּг�װ��δ����)��
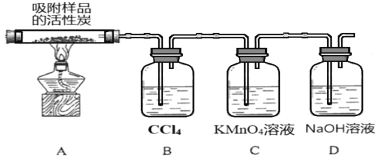
�ټ���ʱA���Թܳ��ֻ���ɫ��װ��B�������� ____________��
��װ��C�е�������___________����Ӧ�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ̶��ݻ����ܱ������н������·�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)����֪��Ӧ������ijһ��SO2��O2��SO3Ũ�ȷֱ�Ϊ0.2mol/L��0.2mol/L��0.2mol/L���ﵽƽ��ʱŨ�ȿ����ǣ� ��
2SO3(g)����֪��Ӧ������ijһ��SO2��O2��SO3Ũ�ȷֱ�Ϊ0.2mol/L��0.2mol/L��0.2mol/L���ﵽƽ��ʱŨ�ȿ����ǣ� ��
A.SO2��O2�ֱ�Ϊ0.4mol/L��0.3mol/L
B.O2Ϊ0.05mol/L
C.SO2��SO3Ũ�Ⱦ�Ϊ0.15mol/L
D.SO2Ϊ0.24mol/L��SO3Ϊ0.16mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z Ϊ��ͬ�����ڷǽ���Ԫ�ص���̬���ʡ���һ���������ܷ������·�Ӧ��Y+X����(g)��Y+Z����(g)����Ϊ10���ӷ��ӣ�ZΪ����ɫ���塣�ס��ҿɻ����������ӻ����
��1��X �ĵ���ʽ��__________���Ľṹʽ��__________��ʵ�����Ʊ�Z�Ļ�ѧ����ʽ___________________��
��2��д��Y+X���Ļ�ѧ����ʽ___________________��
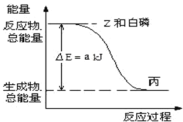
��3����֪�����£�![]() ΪҺ�壬
ΪҺ�壬![]() Ϊ���塣����
Ϊ���塣����![]() ��Z������ȼ������Һ̬�����ӣ�������� Z ���巴Ӧ������1molҺ̬��ʱ�������仯��ͼ��ʾ��д���÷�Ӧ���Ȼ�ѧ����ʽ_______________��
��Z������ȼ������Һ̬�����ӣ�������� Z ���巴Ӧ������1molҺ̬��ʱ�������仯��ͼ��ʾ��д���÷�Ӧ���Ȼ�ѧ����ʽ_______________��
��֪1mol�������Z���巴Ӧ�����ɹ�̬��ʱ������b kJ����1mol��̬��ת��ΪҺ̬��ʱ�ķ�Ӧ��![]() _____��
_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E���ַ�������ԭ�ӵ���Ŀ����Ϊ1��2��3��4��6���Ҷ�����18�����ӣ���֪B��C��D��������Ԫ�ص�ԭ����ɣ���D����������ԭ�Ӹ�����Ϊ1��1����ش�
(1)���A���ӵ�ԭ�ӵĺ�������Ų�ʽ��________________��
(2)B�ķ���ʽ�ֱ��� ___________��C���ӵ�����ṹ��_________ �Σ��÷�������_____________����(���������������Ǽ�����)��
(3)��D��ϡ��Һ�м��������Ȼ�����Һ����Ӧ�Ļ�ѧ����ʽΪ_____________________________
(4) ����1molE����������ȫȼ�գ�ֻ����1molCO2��2molH2O����E�ķ���ʽ�� __________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�1��2-��������ķ�Ӧԭ�����£�
CH3CH2OH![]() CH2=CH2��CH2=CH2+Br2��BrCH2CH2Br
CH2=CH2��CH2=CH2+Br2��BrCH2CH2Br
������������������Ҵ��Ʊ�1��2-���������װ����ͼ��ʾ��
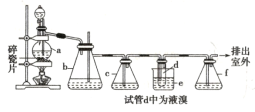
�й������б����£�
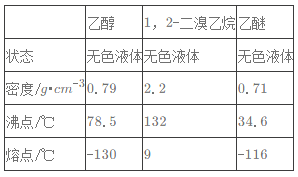
�ش��������⣺
(1)��װ��c��Ӧ����_______(ѡ�����)����Ŀ�������շ�Ӧ�п������ɵ��������塣
��ˮ ��Ũ���� ������������Һ �ܱ���̼��������Һ
(2)�ж�d�����Ʊ�1��2-�������鷴Ӧ�ѽ������������_________��
(3)��1��2-��������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��ˮ��________(��ϡ����¡�)�㡣
(4)��������������δ��Ӧ��Br2�������_______(����ȷѡ��ǰ�����)ϴ�ӳ�ȥ��
��ˮ ������������Һ ���⻯����Һ ���Ҵ�
(5)��1��2-��������Ϊԭ�ϣ��Ʊ�������ϩ��Ϊ�����ԭ�������ʣ���ͬѧ������������̣�1��2-��������ͨ��(��)��Ӧ�Ƶ�(��)����ͨ��(��)��Ӧ�Ƶ�����ϩ��������ϩ�Ƶþ�����ϩ��
��__________________(�Ӧ����)
��__________________(������ʵĵ���ʽ)
��__________________(�Ӧ����)
д����һ���Ļ�ѧ����ʽ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A����ȡ�屽��ʵ��װ�ã�B��C�ǸĽ����װ�á�����ϸ�������Ա�����װ�ã��ش��������⣺


��1��д������װ���з�����Ӧ����Ҫ��ѧ����ʽ��________________��д��B���ұ��Թ�����������Ӧ�Ļ�ѧ����ʽ��__________________��
��2��װ��A��C�������˳��������ܣ���������_______��____________��
��3����ʵ��B��Cװ��������ҩƷ��Ҫʹ��Ӧ��ʼ��Ӧ��װ��B���еIJ�����________________��Ӧ��װ��C���еIJ�����_______________________��
��4��װ��B��C�Ϻõؽ����A�м�װҩƷ��ʹװ�ü�ʱ�ܷ��ì�ܣ������˲�����Aװ������һ������ʵ������ɵĺ����_________________��
��5��B�в�����ϴ��ƿ����װ�ã���������______________________����Ӧ��ϴ��ƿ�п��ܳ��ֵ�������_______________��
��6��Bװ��Ҳ�����������Ե�ȱ�㣬ʹʵ���Ч�����û����������С�������ȱ����_____________________��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����(����)
A.  ˮ��ͭ���ӵ�ģ����ͼ��ʾ��1��ˮ��ͭ��������4����λ��
ˮ��ͭ���ӵ�ģ����ͼ��ʾ��1��ˮ��ͭ��������4����λ��
B.  CaF2����ľ�����ͼ��ʾ��ÿ��CaF2����ƽ��ռ��4��Ca2��
CaF2����ľ�����ͼ��ʾ��ÿ��CaF2����ƽ��ռ��4��Ca2��
C.  Hԭ�ӵĵ�����ͼ��ͼ��ʾ��Hԭ�Ӻ���Ĵ����������ԭ�Ӻ˸����˶�
Hԭ�ӵĵ�����ͼ��ͼ��ʾ��Hԭ�Ӻ���Ĵ����������ԭ�Ӻ˸����˶�
D.  ����Cu��Cuԭ�Ӷѻ�ģ����ͼ��ʾ���ý�������Ϊ���ܶѻ���ÿ��Cuԭ�ӵ���λ����Ϊ12
����Cu��Cuԭ�Ӷѻ�ģ����ͼ��ʾ���ý�������Ϊ���ܶѻ���ÿ��Cuԭ�ӵ���λ����Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУѧ������ͼ��ʾװ�ý���ʵ�飬��̽�������巢����Ӧ��ԭ���������ᴿ��Ӧ�IJ����ش��������⣺

��1��װ��(��)�з�����Ӧ�Ļ�ѧ����ʽΪ 2Fe+3Br2 �T2FeBr3��________ ��
��2��ʵ�鿪ʼʱ���ر� K2������ K1�ͷ�Һ©���������μӱ���Һ��Ļ��Һ�� ����С�Թ��ڱ���������___________��
��3����˵������Һ�巢����ȡ����Ӧ��������___________��
��4����Ӧ������Ҫ��װ��I�е�ˮ������װ�����У�����������Ŀ����___________��������һ�����ķ�����___________ ��
��5���ĸ�ʵ��װ���������������õ�װ����___________��
��6����װ��(��)��Ӧ���Һ�����ν�������ʵ������Ϳɵõ��ϴ������屽��
��������ˮϴ�ӣ�����Һ�� ����5%��NaOH��Һϴ�ӣ�����Һ��
��������ˮϴ�ӣ�����Һ�� ��������ˮCaCl2��ĩ�����________����������ƣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com