
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( ) 
A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3﹣)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)+c(H+)=c(OH﹣)+2c(CO32﹣)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Kb(NH3H2O)>Ka1(H2CO3)
【答案】D
【解析】解:A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣),故A错误; B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),由于碳酸氢根离子的水解程度较小,则c(NH4+)+c(NH3H2O)+c(H+)>c(OH﹣)+2c(CO32﹣)+c(H2CO3),故B错误;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根据图象可知,当溶液pH增大时,铵根离子浓度逐渐减小,而碳酸氢根离子能够先增大后减小,故C错误;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则一水合氨的电离平衡常数大于Ka1(H2CO3),故D正确;
故选D.
A.当pH=9时,结合图象判断溶液中各离子浓度大小;
B.根据碳酸氢铵溶液中的物料守恒分析;
C.该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3﹣浓度变化;
D.碳酸氢铵溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小.


科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如图,b处NaOH的体积为1L,则下列判断正确的是( ) 
A.混合溶液中Al3+的物质的量为0.2mol
B.NaOH的浓度为0.5 mol/L
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa:ab=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)制造光导纤维的主要原料是(写化学式)
(2)硅是用于制造集成电路、电脑芯片、大阳能电池板(光电池,的半导体材料,硅原子结构示意图 .
(3)实验室不用带玻璃塞的试剂瓶盛放NaOH溶液的原因是:(用化学方程式表示) .
(4)硅酸凝胶经干燥脱水形成硅酸干胶,称为“硅胶”.它具有优良的性,常用于干燥剂,也可作催化剂的载体.
(5)硅酸钠(Na2SiO3)的水溶液俗称 , 常用作黏合剂和木材防火材料.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空.
(1)实验室通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式是 . 如有1molCl2生成,被氧化的HCl的物质的量是mol.
(2)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的离子方程式为;
(3)氢氧化亚铁被空气里氧气氧化,反应的化学方程式为 .
(4)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2 , 会出现软而透明的凝胶胶体,同时得到一种钠盐.写出该钠盐的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2O2 = 2H2O+O2↑,下列条件中,反应速率最快的是( )
A. 10 ℃,5 mL 3% H2O2溶液B. 10 ℃,5 mL 5% H2O2溶液
C. 30 ℃,10 mL 5% H2O2溶液D. 30 ℃,5 mL 5% H2O2溶液且加入少量MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.请回答:
(1)实验室制取氨气的化学方程式是 .
(2)该小组同学设计了如图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物. 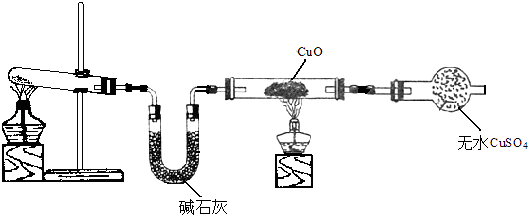
①实验现象为:黑色CuO变为红色;白色水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式 .
②碱石灰的作用是 .
(3)有同学认为:NH3与CuO反应的红色产物中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu2O+2H+=Cu+Cu2++2H2O).探究实验中取小许红色物质于试管中,加入 , 若溶液中出现 , 则说明含有Cu2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水只作氧化剂的是( )
A.2F2+2H2O═4HF+O2
B.2Na+2H2O═2NaOH+H2↑
C.CaO+H2O═Ca(OH)2
D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体、离子晶体、分子晶体采取密堆积方式的原因是( )
A.构成晶体的微粒均可视为圆球
B.三种晶体的构成微粒相同
C.金属键、离子键、范德华力均无饱和性和方向性
D.三种晶体构成微粒的多少及相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题. 
(1)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2 , 制得的Cl2体积(标准状况下)总是小于1.12L的原因是 .
(2)①装置B中盛放的试剂名称为 , 作用是 , 现象是 . ②装置D和E中出现的不同现象说明的问题是 .
③装置F的作用是 .
④写出装置G中发生反应的离子方程式 .
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在与之间(填装置字母序号),装置中应放入(填写试剂或用品称).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com