
| A、②③⑥ | B、④⑤⑥ |
| C、③④⑥ | D、①②③ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
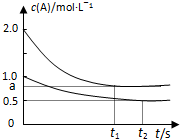 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( ) | 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、k+ |
| B、Al3+ |
| C、SO42- |
| D、明矾溶于水后产生的氢氧化铝胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X=Y |
| B、Y=10-4 X |
| C、X=10-4 Y |
| D、X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、常温下,1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8 mol?L-1盐酸的pH=8.0 |
| D、常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2NaOH=NaCl+NaClO+H2O | ||||
B、2KClO3
| ||||
C、2KMnO4
| ||||
D、2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com