
科目:高中化学 来源: 题型:
| ||
| 充电 |
| A、放电时Cd电极发生氧化反应 |
| B、放电时电解质溶液中的OH-向负极移动 |
| C、放电时负极附近溶液的碱性不变 |
| D、充电时阳极反应:Ni(OH)2+OH-+e-═NiOOH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
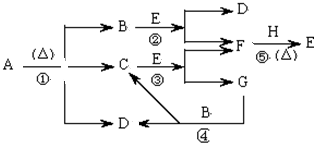
查看答案和解析>>
科目:高中化学 来源: 题型:
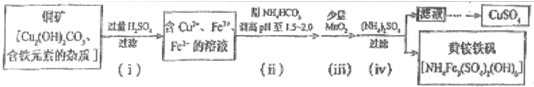
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (系统命名)
(系统命名)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸氢钠溶液与氢氧化钾溶液反应 |
| B、稀硫酸与氢氧化钡溶液反应 |
| C、稀硝酸与氢氧化铜反应 |
| D、醋酸与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑥⑦ | B、①④⑦ |
| C、只有①④ | D、只有⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com