
【题目】下列叙述不正确的是
①3He和4He是同位素 ②金属性:K>Ca>Mg>Be
③四氯化碳的电子式:![]() ④离子键就是阴、阳离子的静电引力
④离子键就是阴、阳离子的静电引力
⑤通常活泼金属与活泼非金属元素形成离子化合物
⑥NaHSO4在熔融状态下电离,破坏了离子键和共价键
⑦用电子式表示溴化氢的形成过程为:![]()
A. ①④⑥ B. ④⑤⑥ C. ③④⑥⑦ D. 全部都不正确
科目:高中化学 来源: 题型:
【题目】由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2→TiCl4![]()
已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141 kJ·mol-1
则TiO2(s) +2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H是
A. -80 kJ·mol-1 B. -160 kJ·mol-1 C. +160 kJ·mol-1 D. +80kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
A. 平衡后升高温度,混合气体中NO含量增大
B. 平衡后降低压强,混合气体平均摩尔质量增大
C. 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
D. 平衡时,将水蒸气移除部分,此时逆反应速率降低,正反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: 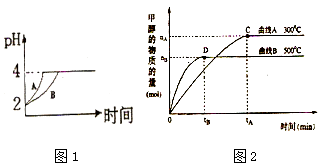
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”). 设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为 m2 . 则 m1 m2 ( 选填“<”、“=”、“>”).
(2)如图2所示,在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)CH3OH(g).升高温度,K值(填“增大”、“减小”或“不变”).在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= .
(3)某温度下Ksp=2×10 ﹣11 , 若该温度下某MgSO4溶液里c(Mg 2+)=0.002molL﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3H2O)=2×10﹣5 , 试计算(填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32﹣水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 I-、 Fe2+、 SO2、 Cl-和 H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为
Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A. 2Fe2++Cl2===2Fe3++2Cl-
B. 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
C. SO2+I2+2H2O===H2SO4+2HI
D. H2O2+H2SO4===SO2↑+O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com