
【题目】有三组含有同族元素的物质,在101.3kPa时测定它们的沸点(℃)如表所示:对应表中内容,下列叙述正确的是( )

A.a、b、c的化学式分别为Ne2、HF、SiH4
B.第②组物质对应水溶液均是强酸
C.第③组中各化合物的热稳定性从上到下依次减弱
D.上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(![]() )的工艺流程如下:
)的工艺流程如下:
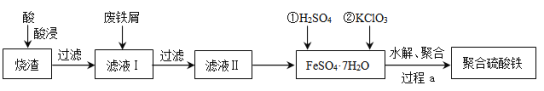
(1)酸浸时最合适的酸是_____(写化学式)。
(2)酸浸后溶液中主要的阳离子有_____。
(3)加入KClO3的目的是_____________________________(结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____Fe2(SO4)3+_____H2O![]() ______Fe2(OH)x(SO4)3-
______Fe2(OH)x(SO4)3-![]() + _____ ______
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:![]() (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。
①该聚合硫酸铁样品中n(OH-) =_________mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将SO2气体逐渐通入某溶液,溶液的pH值随通入的SO2气体体积的变化如图所示,该溶液可能是

A. 氯水B. 氨水C. 氢硫酸D. 食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应中的能量变化,通常主要表现为热量的变化
①硝酸铵固体溶于水:②氢氧化钠溶液滴入醋酸;③食物因氧化而腐败;④氯化铵晶体与氢氧化钡晶休泥合搅拌;⑤加热氯酸钾和二氧化锰混合物制氧气,以上变化中属于吸热反应的是_____(填犏号)。
(2)原电池装置能将化学能转化成电能。某化学小组的同学以30%KOH溶液为电解质溶液,设计氢氧燃料电池结构如图所示

电子从___极流出;溶液中,K+向___极移动,若反应过程中有0.5mo1电子发生转移,则消耗氢气在标准状况下的体积为___L该电池正极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是
4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是

A. 当温度升高后,则图中θ>45°
B. 若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C. 平衡时B的转化率为50%
D. 若再加入B,则平衡后反应体系气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填宇母)。
A.浓氨水、CaO B.NH4Cl固体、Ca(OH)2固体
C.浓氨水 D.NH4NO3固体、NaOH固体
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处宇母),装置A的作用是______________________。
(3)装置C中仪器的名称是___________,盛装的试剂是___________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为___________。
(4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是______________________。
(5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com