
【题目】意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
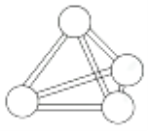
A.N4分子的键角为109°28′B.N4的熔、沸点比N2低
C.N4分子中只含有非极性键D.0.5molN4分子所含共价键数为2NA
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2质量计),某研究小组同学设计了如下实验方案:
I.称取样品Wg后加入足量稀硫酸;
II.将I中产生的SO2用足最H2O2溶液吸收;
III.将II所得溶液用0.lmolL-1氢氧化钠溶液滴定,消耗体积为VmL;
IV.数据处理。
下列是小组同学对实验的设计、分析及数据处理,其中正确的是( )
A.步骤I中可用稀硝酸代替稀硫酸
B.1kg样品中含SO2的质量为![]() g
g
C.若用”溴水”替换II中的氧化剂“H2O2溶液”,对测定结果无影响
D.步骤I中生成的SO2残留在装置中未被H2O2溶液吸收,可能导致测得亚硫酸盐含量偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下列三种有机物:
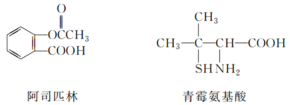
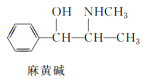
下列叙述不正确的是( )
A.三种有机物都能发生取代反应
B.1mol阿司匹林最多能与3molNaOH反应
C.麻黄碱属于芳香烃,苯环上的一氯代物有3种
D.青霉氨基酸既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
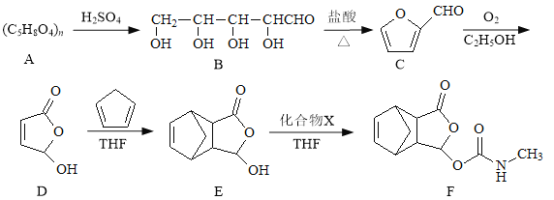
(1)B中手性碳原子数为_________________;化合物C中无氧官能团的名称为_________________。
(2)下列说法正确的是_________________。
A.B与葡萄糖是同系物关系
B.A→B是水解反应
C.E可以发生消去反应,F可与HC1反应
(3)C与银氨溶液反应的化学方程式为_________________。
(4)写出同时满足下列条件的E的同分异构体任意一种结构简式:_________________。
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
(5)已知E+X→F为加成反应,化合物X的结构简式为_________________。
(6)已知: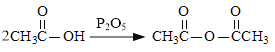 。化合物
。化合物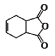 是合成抗病毒药阿昔洛韦的中间体,若以
是合成抗病毒药阿昔洛韦的中间体,若以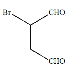 和
和![]() 为原料合成该化合物。请按要求完成下列转化过程:
为原料合成该化合物。请按要求完成下列转化过程: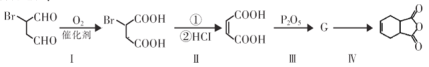
①第I步的反应类型_________________。
②上述步骤Ⅱ中①的反应条件_________________。
③第Ⅲ步中G的结构简式_________________。
④第Ⅳ步的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.碳酸钙与稀盐酸反应:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.硫酸钠溶液和氯化钡溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所
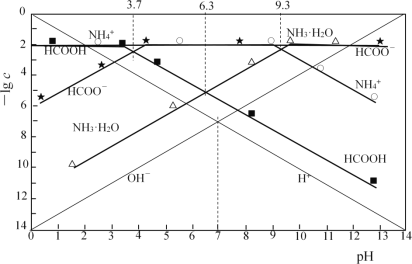
下列说法错误的是
A. 25℃时,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃时,0.01mol·L-1HCOOH溶液的pH为3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
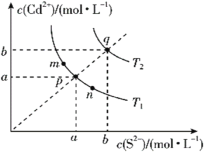
A.T1时CdS在c(S2-)=0.01mol/L的Na2S溶液中,c(Cd2+)=100a2mol/L
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.24g镁与27g铝中,质子数之比为12∶13
B.相同质量的16O2和18O2,体积比为9∶8
C.将1LCmol·L-1氯化钠溶液加入水中稀释为5L,得到0.2Cmol·L-1氯化钠溶液
D.同温同压时,H2和CH4两种气体的密度之比为1∶8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com