
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
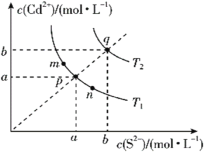
A.T1时CdS在c(S2-)=0.01mol/L的Na2S溶液中,c(Cd2+)=100a2mol/L
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
【答案】B
【解析】
溶度积常数只与温度有关,同温环境下常数不变,根据勒夏特列原理解释平衡移动后离子的浓度变化。
A.根据溶度积公式,c(Cd2+)=![]() =100a2mol/L,A正确;
=100a2mol/L,A正确;
B.CdS的沉淀溶解平衡中,溶度积受温度影响,m、n和p点均为T1时对应的离子浓度,则其溶度积相同,B错误;
C.m点达平衡,向其中加入硫化钠后,平衡逆向移动,c(Cd2+)减小,c(S2-)增大,溶液组成由m沿mnp向p方向移动,C正确;
D.随着温度的升高,离子浓度增大,说明CdSCd2++S2-为吸热反应,则温度降低,q点对应饱和溶液的溶解度下降,溶液中的c(Cd2+)与c(S2-)同等程度减小,会沿qp线向p点方向移动,D正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】新冠疫情期间使用大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
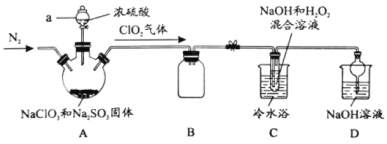
查阅资料:
①ClO2易与碱反应生成亚氯酸盐和氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
回答下列问题:
(1)仪器a的名称_________。
(2)装置A中发生反应的化学方程式:________。
(3)如果撤去C装置中的冷水浴,导致产品中可能混有的杂质是_______。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤③的内容。
①减压,55℃蒸发结晶; ②趁热过滤;③_________; ④低于60℃干燥,得到成品。
(5)写出装置C反应的离子方程式________。
(6)实验结束后,继续通入一段时间N2的目的是________。
(7)利用题中原理制备出NaClO2·3H2O晶体的试样,可以用“间接碘量法”测定试样(杂质与I-不发生反应)的纯度,过程如下:(已知:I2+2![]() =
=![]() +2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
+2I-)取样品0.6000 g配制成250 mL溶液,从中取出25.0 mL加入足量KI固体和适量稀硫酸,再滴加几滴淀粉溶液,然后用0.0600 mol/L Na2S2O3标准溶液滴定,当出现________(填实验现象),达到滴定终点,共消耗该标准溶液25.00 mL,经计算该试样中NaClO2·3H2O的百分含量为______(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
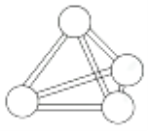
A.N4分子的键角为109°28′B.N4的熔、沸点比N2低
C.N4分子中只含有非极性键D.0.5molN4分子所含共价键数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() =1012的溶液中:Fe2+、Mg2+、NO
=1012的溶液中:Fe2+、Mg2+、NO![]() 、Cl-
、Cl-
B.澄清透明的溶液中:H+、Cu2+、SO![]() 、NO
、NO![]()
C.0.1mol/L的NaHCO3溶液中:Fe3+、K+、Cl-、SO![]()
D.由水电离产生的c(H+)=1×10-12mol/L的溶液中:K+、Al3+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且其离子方程式书写正确的是( )
A.泡沫灭火器中Al2(SO4)3和NaHCO3溶液混合:Al3++3HCO![]() =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
B.用小苏打治疗胃酸过多:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化钨(WC)是大型飞机发动机关键部位材料。
(1)基态钨原子的外围电子排布式为5d46s2,有___个未成对电子。
(2)在第二周期的非金属主族元素中,第一电离能由大到小顺序为___。
(3)硫氰化钾(KSCN)俗称玫瑰红酸钾,是铁离子的检验指示剂。
①SCN-中,中心原子碳的杂化类型是___,该离子的空间构型是___。
②SCN-的等电子体分子是___(任写一个)。
(4)C3H8和纯叠氮酸(HN3)的相对分子质量相近,但C3H8常温下是气态,而纯叠氮酸常温下是一种液体,沸点为308.8K,主要原因是___。
(5)NH3的键角是107°,NF3的键角是102.5°。NF3的键角比NH3的键角小,原因是___。
(6)碳化钨晶胞如图所示。①一个W原子与周围___个碳原子紧密相邻且等距。WC的熔点为2870℃,沸点是3000℃,硬度非常大,它的晶体类型是___。
②已知该晶胞边长为acm,高为hcm,NA为阿伏伽德罗常数。WC的摩尔质量为Mg·mol-1。该晶体密度为___g·cm-3。
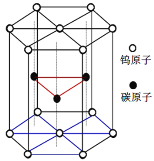
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置 | 实验数据 |
|
|
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体锌二次电池具有电压高、成本低、安全性强和可循环使用等特点。已知:①Zn(OH)2+2OH-=Zn(OH)![]() ;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
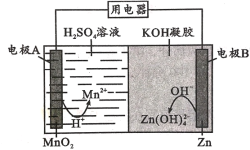
A.电池放电时,电子由电极B经导线流向电极A
B.电池反应为MnO2+ Zn + 4H++4OH-=Mn2+ + Zn(OH)![]() +2 H2 O
+2 H2 O
C.电池充电时,H+向电极A移动
D.电池充电时,电极B的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.  水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 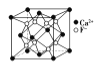 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com