
����Ŀ����Ԫ����������ȶ���һ��ͬ���������ǻ�ɫ�����������ͣ�1912��E.Beckmann�����ڵ��еı��㽵�ͷ����������S8���ӡ�1891�꣬M.R.Engel��Ũ�������������εı�����Һ��0���������״��Ƶ���һ�����ε�![]() ������֤������S6���ӡ�����˵����ȷ����
������֤������S6���ӡ�����˵����ȷ����
A.S6��S8���Ӷ�����Sԭ����ɣ�����������һ������
B.S6��S8���ӷֱ������۷�Ӧ�����ò��ﲻͬ
C.S6��S8���ӷֱ��������������Ӧ���Եõ�SO3
D.��������S6��S8���ӷֱ���������KOH��Ӧ������KOH�����ʵ�����ͬ
���𰸡�D
��������
Aѡ����S6��S8���Ӷ�����Sԭ����ɣ������Dz�ͬ�����ʣ���Ϊͬ�������壬��A����
Bѡ�S6��S8����Ԫ�صIJ�ͬ���ʣ���ѧ�������ƣ�������Ƿֱ������۷�Ӧ�����ò�����ͬ����B����
Cѡ�����������������������S6��S8���ӷֱ���������Ӧ���Եõ�SO2����C����
Dѡ���������S6��S8���ӣ�����ԭ�ӵ����ʵ�����ͬ��������Ƿֱ���������KOH��Ӧ������KOH�����ʵ�����ͬ����D��ȷ��
������������ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У�������Ӧ2NO2(g)![]() N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
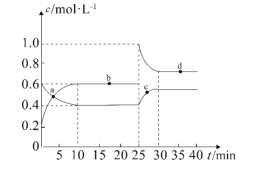
��0��10min��ƽ����Ӧ���ʣ�v((NO2)=___________mol��L��1��min��1��
��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����v(��)��v(��)�ĵ���___________��
��������Ӧ��Ӧ���е�25minʱ�������������ڳ���һ����NO2�����´ﵽƽ����������NO2�����������___________(������������������������С��)���÷�Ӧ��ƽ�ⳣ��K=___________(����������1λС��)��
��2��һ���¶��º��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g)![]() 2I(g)(�췴Ӧ)
2I(g)(�췴Ӧ)
�ڶ���I(g)+N2O(g)��N2(g)+IO(g)(����Ӧ)
������IO(g)+N2O(g)��N2(g)+O2(g)+I(g)(�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5��kΪ���ʳ����������б�����ȷ����___________(����)��
a��N2O�ֽⷴӦ�У�k(����)>k(�⣩b����һ�����ܷ�Ӧ�������������
c���ڶ�����ܱȵ�������d��I2Ũ����N2O�ֽ�������
��3��F.Daniels�������ò�ѹ���ڸ��Է�Ӧ�����о���25��ʱN2O5(g)�ֽⷴӦ��
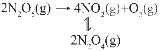
����NO2����ΪN2O4�ķ�Ӧ����Ѹ�ٴﵽƽ�⣬��ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ��t=��ʱ��N2O5(g)��ȫ�ֽ⣩��
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | �� |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
��25��ʱ2NO2(g)![]() N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
��t=200minʱ�������ϵ��p(N2O4)=6.5kPa�����ʱ��N2O5ת����Ϊ___________��(����������1λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2Fe2++Cl2=2Cl��+2Fe3+��2Br��+Cl2=Br2+2Cl����2Fe2++Br2=2Br��+2Fe3+����bL FeBr2��Һ��ͨ��amol Cl2ʱ��ʹ��Һ��50% ��Br������ΪBr2����ԭFeBr2�����ʵ���Ũ��Ϊ
A. a/bmolL��1 B. 2a/bmolL��1 C. 3a/bmolL��1 D. 5a/bmolL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������
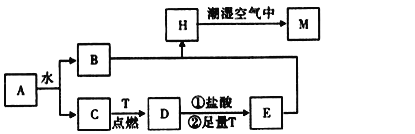
��1������A�Ļ�ѧʽΪ___��
��2��H�ڳ�ʪ�����б��M��ʵ��������__����ѧ����ʽΪ___��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ__���г�A��һ����Ҫ��;__��
��4����Ӧ�ٵ����ӷ���ʽΪ__���ڼ�����T��Ŀ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У���������������ԭ�����͵���
A.����������еİ�Һ�������ںϳɰ���Ӧ
B.��CO(g)+NO2(g)![]() CO2(g)+NO(g)ƽ����ϵ����ѹǿ��ʹ����ɫ����
CO2(g)+NO(g)ƽ����ϵ����ѹǿ��ʹ����ɫ����
C.�����£���1mLpH��3�Ĵ�����Һ��ˮϡ�͵�100mL�������pH��5
D.ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������25mL0.1mol/LNaOH��Һ����εμ�0.2mol/L��HN3�������ᣩ��Һ��pH�ı仯������ͼ��ʾ����Һ���ʱ����ı仯���Բ��ƣ��������Ka��10��4.7��������˵����ȷ����
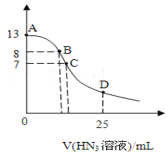
A.ˮ�������c(H+)��A�����B��
B.��A�㵽C�㣬������c(Na+)>c(N3��)>c(OH��)>c(H+)
C.��C�㣬�μӵ�V(HN3)>12.5mL
D.��D�㣬c(Na+)��2c(HN3)+2c(N3��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NA���������ӵ�������ֵ������˵������ȷ����
A.20g NaOH����1Lˮ�������0.5mol/LNaOH��Һ
B.100mL 0.1mol/L������Һ�к��е���ԭ����ԼΪ0.04NA
C.5 mL 0.3 mol/L Na2SO4��Һ��5 mL 0.3 mol/L NaNO3��ҺNa�� ���ʵ���Ũ�����
D.a g C2H4��C3H6�Ļ��������̼ԭ����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ijС�����ù�ҵ�����ӽ���Ĥ�����ռ��ԭ��������ͼ��ʾװ�õ��K2SO4��Һ��
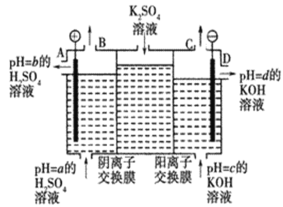
��1���õ��۵�������ӦʽΪ__________________________________��ͨ�������ӽ���Ĥ��������___________(�>����<������)ͨ�������ӽ���Ĥ��������
��2��ͼ��a��b��c��d�ֱ��ʾ�й���Һ��pH����a��b��c��d��С�����˳��Ϊ___________
��3�����һ��ʱ���B����C�ڲ��������������Ϊ___________
��.�������ö��Ե缫���200mLNaCl��CuSO4�Ļ����Һ����������������ʱ��仯��ͼ��ʾ������ͼ����Ϣ�ش��������⡣(��������ѻ���ɱ�״���µ�������Һ���������ˮ�е��ܽ����Һ����ı仯)
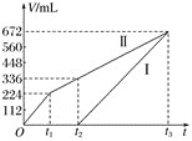
��1������___________(������������)��ʾ������������ı仯
��2��CuSO4�����ʵ���Ũ��Ϊ___________mol/L
��3��t1ʱ������Һ�ָ���ԭ��״̬���___________���������ƣ�����___________g
��4��t2ʱ������Һ��pHΪ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)53��Na2CO3�����ʵ�����________������Na+��CO32-�����ʵ�������_____________��
(2)�ڱ�״���£����1.32 gij��������Ϊ0.672 L����������Ħ������_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com