
【题目】Ⅰ.某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
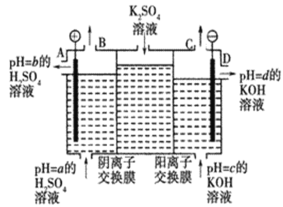
(1)该电解槽的阳极反应式为__________________________________,通过阴离子交换膜的离子数___________(填“>”“<”或“=”)通过阳离子交换膜的离子数
(2)图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为___________
(3)电解一段时间后,B口与C口产生气体的质量比为___________
Ⅱ.常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
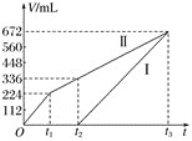
(1)曲线___________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化
(2)CuSO4的物质的量浓度为___________mol/L
(3)t1时所得溶液恢复到原来状态需加___________(物质名称)质量___________g
(4)t2时所得溶液的pH为___________
【答案】2H2O—4e—=O2↑+4H+ < b<a<c<d 8:1 Ⅱ 0.1 氯化铜 1.35 1
【解析】
Ⅰ.(1)阳极失电子发生氧化反应,据此书写电极反应方程式;电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2;SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动;
(2)OH-被氧化,阳极生成H+和O2,pH减小,阴极发生还原反应生成H2和OH-,pH增大;
(3)B口生成氧气,C生成氢气。
Ⅱ.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,据此分析解答。
Ⅰ.(1)阳极失电子发生氧化反应,则电极反应式为2H2O-4e-═O2↑+4H+;电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知硫酸根离子数目小于钾离子数目,故答案为:2H2O-4e-═O2↑+4H+;<;
(2)阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b<a<c<d,故答案为:b<a<c<d;
(3)B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32∶4=8∶1,故答案为:8∶1。
Ⅱ.刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑;
(1)通过以上分析知,I表示阴极生成的气体、II表示阳极生成的气体,故答案为:Ⅱ;
(2)Ⅱ曲线中由t1 到t2时生成氧气为112mL,n(O2)=![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)=![]() =0.1mol/L,故答案为:0.1;
=0.1mol/L,故答案为:0.1;
(3)t1时发生2Cl--2e-=Cl2↑,则氯离子减少,故应加入氯化铜可恢复到原来状态;224mL氯气,相当于0.01mol氯气,根据氯元素守恒得 n(CuCl2)=n(Cl2)=0.01mol,则m(CuCl2)=0.01mol×135g/mol=1.35g,故答案为:氯化铜;1.35;
(4)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=![]() =0.1mol/L,则溶液的pH=1,故答案为:1。
=0.1mol/L,则溶液的pH=1,故答案为:1。


科目:高中化学 来源: 题型:
【题目】S16O2与18O2在高温条件下发生反应2SO2+O2![]() 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann由硫在碘中的冰点降低法测得它含有S8分子。1891年,M.R.Engel用浓盐酸和硫代硫酸盐的饱和溶液在0℃下作用首次制得了一种菱形的![]() -硫,后来证明含有S6分子。下列说法正确的是
-硫,后来证明含有S6分子。下列说法正确的是
A.S6和S8分子都是由S原子组成,所以它们是一种物质
B.S6和S8分子分别与铁粉反应,所得产物不同
C.S6和S8分子分别与过量的氧气反应可以得到SO3
D.等质量的S6和S8分子分别与足量的KOH反应,消耗KOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
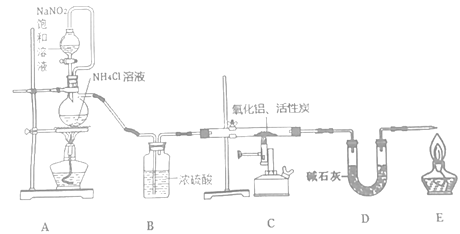
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )

A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用作有机合成的中间体,其质谱图表明其相对分子质量为84。已知16.8 g A完全燃烧生成44.0 g CO2和14.4 g H2O。请回答下列问题:
(1)A的分子式是____________。
(2)若红外光谱分析表明A分子中含有羟基和位于分子一端的C≡C键,且核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1,则A的结构简式是_______。
(3)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。写出B与新制氢氧化铜反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚________________________________________;
(2)1,3﹣丁二烯与等物质的量的单质溴在60℃时发生1,4﹣加成_________________________;
(3)1,2﹣二溴乙烷与氢氧化钠水溶液共热________________;
(4)乙醛的还原______________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
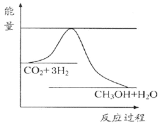
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)该反应平衡常数K的表达式为_________________。
(2)温度降低,平衡常数K_________(填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,CO2和H2的转化率比是________。
(4)下列措施中能使(3)题中![]() 增大的有____________。(填字母)
增大的有____________。(填字母)
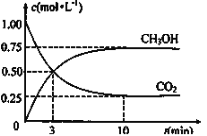
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1mol CO2和3mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com