
【题目】下列离子方程式正确的是![]()
A.![]() 与HI溶液反应:
与HI溶液反应:![]()
B.工业制漂白粉:![]()
C.![]() 与稀硫酸反应:
与稀硫酸反应:![]()
D.物质的量浓度之比为1:2的![]() 溶液与
溶液与![]() 溶液等体积混合:
溶液等体积混合:![]()
【答案】C
【解析】
A.Fe2O3与HI溶液反应的离子反应为Fe2O3+6H++2I—=2Fe2++I2+3H2O,故A错误;
B.微溶物形成溶液才能拆成离子,工业制漂白粉是用石灰乳和氯气反应,石灰乳存在的主要是固体,所以不能拆只能写化学式,离子反应为:Cl2+Ca(OH) 2=Ca2++Cl—+ClO—+H2O,故B错误;
C. S2O32—与H+反应生成硫沉淀和二氧化硫,离子反应为:S2O32—+2H+=S↓+SO2↑+H2O,故C正确;
D.物质的量浓度之比为1:2的NH4Al(SO4)2溶液与Ba(OH) 2溶液等体积混合,生成BaSO4沉淀、Al(OH) 3沉淀和NH3H2O,反应的离子方程式为:Al3++NH4++2SO42—+2Ba2++4OH—=Al(OH) 3↓+2BaSO4↓+NH3·H2O,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
B.![]()
(1)在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为_______________________________________。
(2)尿素合成过程中通过控制温度、![]() 和
和![]() 的物质的量比
的物质的量比![]() 氨碳比
氨碳比![]() 等因素来提高
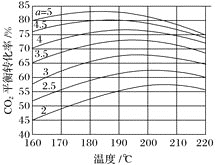
等因素来提高![]() 的转化率。如图是在其他因素一定,不同氨碳比条件下
的转化率。如图是在其他因素一定,不同氨碳比条件下![]() 平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,
平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,![]() 转化率越大,其原因是___________当a一定时,
转化率越大,其原因是___________当a一定时,![]() 平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。
平衡转化率呈现先增大后减小的趋势,其原因为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种治疗艾滋病的新药(结构简式见图),已知M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是
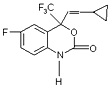
A.该物质易溶于水
B.M能发生缩聚反应
C.M分子内至少有15个原子在同一个平面上
D.M的分子式为C13H22O2NF4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知1g硫完全燃烧释放的热量为akJ,写出硫的燃烧热的热化学方程式__;
(2)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=__kJ·mol-1(用含a、b的代数式表示);
(3)已知 2SO2(g)+O2(g)=2SO3(g) △H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
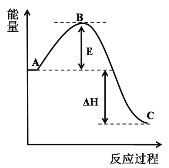
①图中A表示___;
②E的大小对该反应的反应热__(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列叙述中正确的是( )
表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,20g![]() 和足量的金属钠反应产生气体的分子数为
和足量的金属钠反应产生气体的分子数为![]()
B.1mol![]() 与足量的水反应,转移的电子数为
与足量的水反应,转移的电子数为![]()
C.![]() 个
个![]() 分子在标准状况下的体积为
分子在标准状况下的体积为![]() L
L
D.![]() 时,
时,![]() 的
的![]() L
L![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A.甲烷与乙烷的体积比是1∶4B.丙炔与乙炔的体积比是1∶4
C.乙烯与丁烷的体积比是1∶4D.乙烯与丁烯的体积比是1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡态,此时剩余1.2molB,并测得C的浓为1.2mol·L-1。
xC(g)+2D(s),2min后反应达到平衡态,此时剩余1.2molB,并测得C的浓为1.2mol·L-1。
(1)从反应开始至达到平衡状态,生成C的平均应速率为_。
(2)x=__。
(3)下列各项可作为该反应达到平衡状态标志是_(填序号)。
A.压强不再变化
B.气体密度不再变化
C.气体的平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香羧酸通常用芳香烃的氧化来制备,某同学用甲苯的氧化反应制备苯甲酸。已知:![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
反应试剂、产物的物理常数:
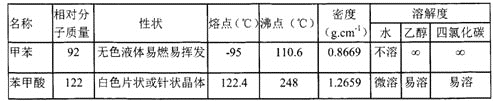
主要实验装置和流程如下:
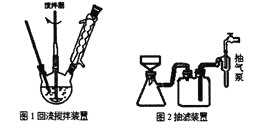
实验方法:向图1装置中依次加入2.8mL甲苯、200mL水和8.6g高锰酸钾,通冷凝水,加热至沸腾,在反应过程中,甲苯不断的被冷凝回流,反应结束后,按以下步骤操作,得到苯甲酸粗产品。
![]()
(1)图1装置中反应结束的标志是__,趁热抽滤的目的是__。
(2)写出浓盐酸酸化时的所有离子反应方程式__。
(3)下列说法正确的是__。
A.图1装置中的反应混合物抽滤时应用玻璃砂漏斗替代布氏漏斗
B.在冷却抽滤时,若有产品黏在瓶壁上,可用滤液淋洗,直到所有晶体收集到布氏漏斗中,再次抽滤
C.苯甲酸粗产品的杂质除KCl外还可能含有甲苯,均可用蒸馏水洗涤除去
D.抽滤结束,为防止倒吸,应先关闭水龙头,再拆掉抽气泵和吸滤瓶之间的橡皮管
(4)苯甲酸纯度测定:用__(填仪器名称)称取1.220g产品,加合适溶剂溶解,再用蒸馏水稀释配成100mL溶液,取25.00mL溶液,滴加几滴指示剂,用0.1000molL-1NaOH标准液进行滴定,平行滴定3次,平均消耗标准液体积为21.00mL
①“合适溶剂”和“指示剂”分别为__。
A.蒸馏水和酚酞 B.乙醇和甲基橙 C.四氯化碳和酚酞 D.乙醇和酚酞
②苯甲酸产品的纯度为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com