
【题目】标准状况下11.2LCH4在空气中完全燃烧,请完成下列问题:
(1)写出该反应的化学方程式_______;
(2)计算标准状况下11.2LCH4的质量_______;
(3)计算生成CO2的质量_______。[(2)(3)写出计算过程]
【答案】CH4+2O2![]() CO2+2H2O 8g 22g
CO2+2H2O 8g 22g
【解析】
(1)甲烷在空气中燃烧生成二氧化碳与水;(2)根据n=![]() 计算甲烷的物质的量,再根据m=nM计算甲烷的质量;(3)根据(1)中的化学方程式计算生成二氧化碳的质量。
计算甲烷的物质的量,再根据m=nM计算甲烷的质量;(3)根据(1)中的化学方程式计算生成二氧化碳的质量。
(1)甲烷在空气中燃烧生成二氧化碳与水,反应方程式为:CH4+2O2![]() CO2+2H2O,故答案为:CH4+2O2
CO2+2H2O,故答案为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)甲烷的物质的量=![]() =0.5mol,故甲烷的质量=0.5mol×16g/mol=8g,故答案为:8g;
=0.5mol,故甲烷的质量=0.5mol×16g/mol=8g,故答案为:8g;
(3)CH4+2O2![]() CO2+2H2O
CO2+2H2O
1mol 44g
0.5mol m(CO2)
则![]() =
=![]() ,解得:m(CO2)=22g,故答案为:22g。
,解得:m(CO2)=22g,故答案为:22g。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
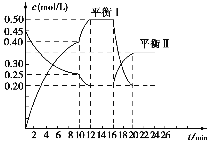
请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与对应叙述相符合的是

A. 图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B. 图乙表示向CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应时放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:

(1)分别写出①②的数值:
①____________; ② ____________ ;
(2)生成H2O(g)中的1mol H-O键放出____________kJ的能量;
(3)已知:H2O(l)= H2O(g) △H = +44 kJ·mol-1 ,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液。
(1)写出0.1 mol·L-1一元弱酸HA的电离方程式___________________。
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为_____________________。
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为___________________;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是_________________。
①c(H+) ②n(A-) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA)
(5)实验室在配制溶液时,一些物质存在水解的情况,在配制Fe2(SO4)3溶液时,Fe3+也存在水解,请书写水解离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是

A. Ni电极表面发生了还原反应
B. 阳极的电极反应为:2O2—-4e-=O2
C. 电解质中发生的离子反应有:2SO2 +4O2—=2SO42—
D. 该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) ![]() x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为20% D. 平衡时N的浓度为0.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学相关知识,完成以下实验题。
Ⅰ.实验室中盐酸的用途十分广泛,常常用来制备气体
(1)某小组同学欲用4mol/L的盐酸配制230mL0.4mol/L盐酸溶液,需用量筒取用4mol/L盐酸_____mL,实验中需要用到的玻璃仪器有_____、_____、量筒、烧杯、玻璃棒。
(2)下列实验操作使配制的溶液浓度偏低的是_____。
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
Ⅱ.已知铁屑和氯气在500~600℃下可制取无水FeCl3,如图是制取氯化铁粉末所需的装置,已知氯化铁粉末容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。请回答下列问题。

(1)按照气体流向从左到右的顺序连接仪器(填仪器接口):①接____,____接____,____接②。
(2)A装置的烧瓶中发生反应的离子方程式为_____,B装置中发生反应的化学方程式为____。
(3)D装置的作用是_____;E装置的作用是_____。
(4)实验开始时,应先点燃_____(填“A”或“B”)处的酒精灯。
(5)这套实验装置是否完整?____(填“是”或“否”)。若不完整,还须补充__(若第一空填“是”,则此空不需要作答)装置。
(6)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是____(填序号)。
①CO2 ②HCl ③H2O ④H2
A.①②③ B.②③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为2.5
A(g)+B(g)的平衡常数为2.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com