
【题目】下列说法正确的是( )
A.因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸中,浓硝酸中铝片先溶解完
B.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
C.N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
D.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. 1molCO 完全燃烧,放出热量为283 J
B. Na2O2(s)+CO2(s)=Na2CO3(s)+ ![]() O2(g) △H=-226 kJ·mol-l
O2(g) △H=-226 kJ·mol-l
C. CO(g) 与Na2O2(s)反应放出509kJ 热量时,电子转移数为1.204×1024
D. CO 的燃烧热为566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
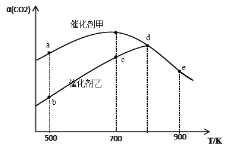
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 molBaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能存在大量Ag+、Mg2+、Fe3+、Cu2+中的一种或几种,请填写下列空白。
(1)不用做任何实验就可以肯定溶液中不存在的离子是________________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明原溶液中肯定存在的离子是_______,有关反应的离子方程式为___________。
(3)取(2)的滤液加过量的NaOH溶液,出现白色沉淀,说明原溶液中肯定有________,有关反应的离子方程式为_________________________。
(4)原溶液中可能大量存在的阴离子是________(填序号)。
A.Cl- B.NO3- C. CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中正确的是( )

A.图Ⅰ所示电池中,负极电极反应为Zn-2e-![]() Zn2+
Zn2+
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
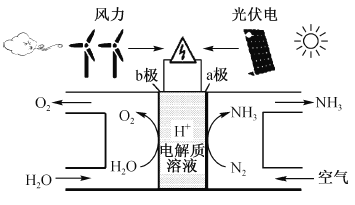
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既作氧化剂又作还原剂的是( )
A. 2F2+2H2O===4HF+O2 B. 2Na+2H2O===2NaOH+H2↑
C. CaO+H2O===Ca(OH)2 D. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
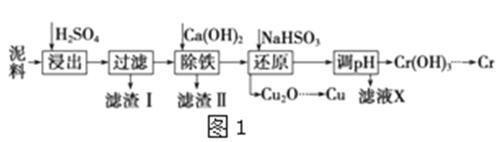
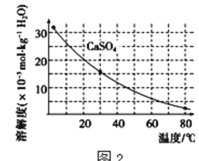
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__;
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到约__,检验Fe3+已经除尽的操作是__;②将浊液加到80℃,__;
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式__,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是__;
(4)在FeS饱和溶液中存在:FeS(s)![]() Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com