
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________________________
(中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________。

(2)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
滴定终点的判断__________________________
【答案】HCl(aq)+NaOH(aq)= NaCl(aq)+H2O(l) △H=﹣57.3 kJ/molB23.80 mL0.1044 mol·L-1AC当最后一滴标准液盐酸滴入到锥形瓶中时,溶液颜色由红色变为无色,且30秒不变色,即为滴定终点。
【解析】Ⅰ.(1)强酸强碱的中和热为-57.3kJ/mol,即强酸和强碱的稀溶液完全反应生成1mol水放出的热量为57.3kJ,则稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,温度差偏小,中和热的数值偏小,故正确;B.量取盐酸的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故错误;C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,故正确;D.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故正确;故选ACD;
Ⅱ.(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.90ml,滴定管中的液面读数为24.90ml-1.10ml=23.80 mL;
(2)第二组读数误差太大舍去,标准液消耗的体积V(标准液)=![]() =26.10ml;根据c(待测)=
=26.10ml;根据c(待测)=![]() =0.1044molL-1;
=0.1044molL-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;故答案为AC;
滴定终点的判断方法是当最后一滴标准液盐酸滴入到锥形瓶中时,溶液颜色由红色变为无色,且30秒不变色,即为滴定终点。


科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
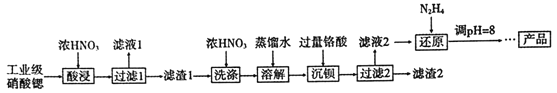
已知: ①“滤液1”的主要溶质是Ca(NO3)2;“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2;“滤渣2”的主要成分为BaCrO4
②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是_______。
(2)相对于水洗,用浓HNO3洗涤的优点是_______。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出反应的离子方程式____。
(4)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
Cr3+(aq) +3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。现将还原后溶液的pH值调至4,此时Cr3+是否沉淀完全? ___( 列式计算)。
(5)已知Cr(OH)3类似Al(OH)3,还原后溶液的pH不能大于8的原因是_______(结合离子方程式说明理由)。
(6)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
m g“滤渣2”![]() 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①若加入的HI溶液过量太多,测定结果会_____(填“偏低”、“偏高”或“无影响”)。
②“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为_____(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
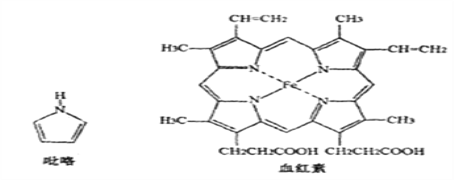
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
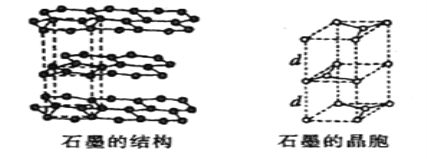
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. MnO2+ 4HCl(浓)![]() MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
MnCl2 +Cl2↑ + 2H2O中,氧化剂和还原剂物质的量之比为1∶4
B. 2H2S+ SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为1∶1
C. 3S+ 6KOH=2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2∶1
D. Al2O3+N2+3C![]() 2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
2AlN+3CO中,氧化剂和还原剂物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,完成下列填空:
(1)1molCH4含 碳原子________mol,含氢原子___________mol。
(2)标准状况下,0.5mol个CO2分子所占有的体积为________。
(3)标准状况下,33.6LH2所含的分子数目为________。
(4)34g H2O2的物质的量为________; 0.5molH2SO4的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )

① ② ③ ④
A. ①③②④ B. ①②③④
C. ①④③② D. ①③④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 14 g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为NA
D. 15 g 甲基中所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
甲、乙两池电极材料都是铁棒与碳棒如图。若两池中均盛放氯化钠溶液,反应一段时间后,请回答下列问题:

(1)甲池中铁作______极,乙池中铁作_______极。
(2)甲池中铁电极反应__________________,碳电极反应________________。
(3)乙池中总反应化学方程式__________________。
II(化学与生活)
材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金尾材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是___________(填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于______(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式______。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_____反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com