
【题目】合成某种滴眼液的原料为4-二甲氨基吡啶。下列叙述错误的是( )
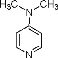
A.该分子中C原子的杂化类型有sp2、sp3
B.该分子中N原子的杂化类型有sp2、sp3
C.1mol该分子所含的σ键为15NA
D.该分子中含的大π键为Π![]()
科目:高中化学 来源: 题型:
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷(P4)的正四面体结构如图所示,能与Ba(OH)2溶液发生反应: 2P4+3Ba(OH)2 + 6H2O=3Ba(H2PO2)2 +2PH3↑。若该反应消耗白磷3.1g,则下列说法正确的是( )
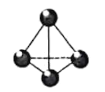
A.水是还原剂,消耗水的质量为1.35g
B.产生PH3,气体560mL
C.转移0. 75 mol电子
D.反应断开了0.15 molP-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机金属配合物二茂铁(Fe(C5H5)2)的发现具有里程碑意义。已知二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A.二茂铁属于分子晶体
B.在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C.已知,环戊二烯的结构式为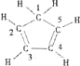 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D.C5H5-中一定含有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与Cl原子结合形成的RCl5分子在气态和液态时,分子结构如图所示,下列有关于RCl5分子的说法中不正确的是( )
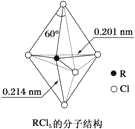
A.分子中5个R-Cl键的键能不都相同
B.键角(Cl-R-Cl)有90°、120°、180°几种
C.每个原子都达到8电子稳定结构
D.RCl5受热分解生成的RCl3分子的立体结构呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
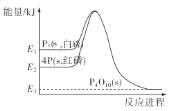
A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 是化学中常见的物质。常温下,E 是一种无色无味的液体,它们之间有如下反应关系。

(1)若 A 是一种具有磁性的黑色金属氧化物,B 是一种常见的非氧化性酸,A 和 B 反应的离子方程式为________;若在生成物 C 中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式________________________________。A 与 CO 高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式________________________________。
(2)若实验室中利用固体 A 和 B 的反应制备气体 C,C 是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________________________;实验室检验 C 的方法为________________________________。
(3)若 B 是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为
________________________________。若用湿润的淀粉碘化钾试纸靠近盛满 B 的试管口,看到的现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
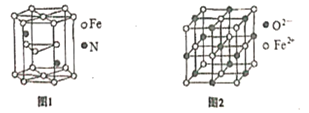
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com