
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行aN(g)![]() bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中![]() =______。
=______。
(2)t2时两线交叉点__平衡状态(填“是”或“不是”),v正__v逆(填“>”“<” 或“=”)。
(3)此反应达到平衡时,反应物的转化率为____________。
(4)下列描述能说明上述反应达到平衡状态的是__________。
①反应中M与N物质的量之比为2∶5;②混合气体的总物质的量不随时间的变化而变化;③M的转化率达到最大;④如容器为绝热容器,体系内温度不再变化。
II.某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色) ![]() 2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
(1)前4 s以N2O4浓度变化表示的平均反应速率为________________。
(2)在4 s末时容器内的压强是开始时的___________倍。
(3)平衡时容器内NO2的浓度是__________________。
【答案】2 不是 > 75% ②③④ 0.005 mol·L-1·s-1 1.2倍 0.16 mol·L-1
【解析】
Ⅰ.(1)化学方程式的系数之比等于各物质的物质的量的变化量之比;
(2)t2时两线交叉点反应物浓度还在减小,生成物在增大,故不是平衡状态,反应在向正向进行,v正>v逆;
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,在结合转化率定义计算;
(4)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断;
II.(1)根据v=![]() 计算二氧化氮的速率,再根据速率之比=计量数之比计算四氧化二氮的速率;
计算二氧化氮的速率,再根据速率之比=计量数之比计算四氧化二氮的速率;
(2)根据n=cV计算4s时NO2的物质的量,结合方程式计算参加反应四氧化二氮的物质的量,进而计算4s时混合气体总物质的量,恒温恒容下,气体压强之比等于其物质的量之比;
(3)恒温恒容下,气体压强之比等于其物质的量之比,据此计算平衡时混合气体总物质的量,根据方程式利用差量法计算消耗的N2O4的物质的量,进而计算NO2的平衡浓度。
Ⅰ.(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中![]() =2:1;
=2:1;
(2)t2时两线交叉点反应物浓度还在减小,生成物在增大,故不是平衡状态,反应在向正向进行,v正>v逆;
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,故N的转化率为![]() ×100%=75%;
×100%=75%;
(4)①平衡时反应混合物各组分的物质的量不变,但M与N物质的量之比为2:5不一定平衡,故①错误;
②由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故②正确;
③M的转化率达到最大,说明达到限度,达到平衡,故③正确;
④如容器为绝热容器,体系内温度为变量,温度不再变化说明平衡,故④正确;
故答案为:②③④;
II.(1)4s时NO2的浓度为0.04mol/L,则v(NO2)=![]() =0.01molL-1s-1,v(N2O4)=
=0.01molL-1s-1,v(N2O4)=![]() ×0.01molL-1s-1=0.005molL-1s-1;
×0.01molL-1s-1=0.005molL-1s-1;
(2)4s时NO2的物质的量为10L×0.04mol/L=0.4mol,则参加反应N2O4的物质的量为0.4mol×![]() =0.2mol,故4s时混合气体总物质的量为(1mol-0.2mol)+0.4mol=1.2mol,恒温恒容下,气体压强之比等于其物质的量之比,故4s时容器内的压强为开始时的
=0.2mol,故4s时混合气体总物质的量为(1mol-0.2mol)+0.4mol=1.2mol,恒温恒容下,气体压强之比等于其物质的量之比,故4s时容器内的压强为开始时的![]() =1.2倍;
=1.2倍;
(3)恒温恒容下,气体压强之比等于其物质的量之比,则平衡时混合气体总物质的量为1mol×1.8=1.8mol,则:
N2O4![]() 2NO2 △n
2NO2 △n
1mol 1mol
0.8mol 1.8mol-1mol=0.8mol
则参与反应的四氧化二氮为0.8mol,生成的N2O4为1.6mol,平衡时容器内NO2的浓度是![]() =0.16molL-1。
=0.16molL-1。


科目:高中化学 来源: 题型:
【题目】如图是某只含C、H、O三种元素的有机物分子的球棍模型。关于该物质的说法正确的是
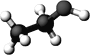
A.分子式为CH3COOH
B.能用于萃取碘水中的单质碘
C.能使紫色石蕊试液变红色
D.能与金属钠反应生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再用待测溶液润洗后,注入待测溶液,然后调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗后,向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③用蒸馏水将锥形瓶洗净后,从碱式滴定管中放入20.00mL待测溶液,滴入甲基橙作指示剂,然后用标准盐酸进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL;
④重复以上过程,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中溶液的颜色从_________色变为___________色时,停止滴定。
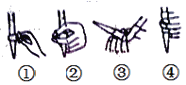
(2)下图中,第②步“调节滴定管的尖嘴部分充满溶液”方法正确的是_________,如果滴定前有气泡,滴定后气泡消失,由此对测定结果形成的影响是___________(填“偏高”、“偏低”或“无影响”)
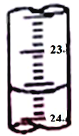
(3)图中是某次滴定时的滴定管中的液面,其读数为__________mL。
(4)根据下列数据:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 24.10 |
第二次 | 20.00 | 3.00 | 27.10 |
请计算待测烧碱溶液的浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )

A.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1LCuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
B.M连接电源正极,N连接电源负极,将C电极换成Cu电极,电解质溶液换成硫酸铜溶液,则可实现在铁上镀铜
C.M连接电源正极,N连接电源负极,当两极产生气体总量为22.4mL(标准状况)时,则生成0.001molNaOH
D.去掉电源,将M、N用导线直接相连,在溶液中滴入酚酞试液,C电极周围溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )
A. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=-48.40 kJ·mol-1
B. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=+5 518 kJ·mol-1
D. C8H18(l) + O2(g)![]() 8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
8CO2(g) + 9H2O(l) ΔH=+48.40 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯:
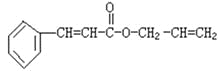 可简化为
可简化为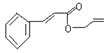 ,杀虫剂“阿乐丹”的结构表示为
,杀虫剂“阿乐丹”的结构表示为 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.遇FeCl3溶液均显紫色B.均能发生银镜反应
C.均能与溴水发生反应D.均能与NaHCO3溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
A.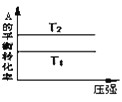 由图可以判断:若
由图可以判断:若![]() ,反应
,反应![]() 的
的![]()
B. 图表示压强对可逆反应
图表示压强对可逆反应![]() 的影响,乙的压强比甲大
的影响,乙的压强比甲大
C.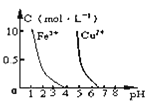 根据图,若除去
根据图,若除去![]() 溶液中的
溶液中的![]() ,可向溶液中加入适量NaOH溶液,调节
,可向溶液中加入适量NaOH溶液,调节![]()
D.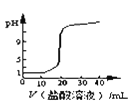 图表示用
图表示用![]() 的盐酸滴定20mL
的盐酸滴定20mL![]() 溶液,pH随加入盐酸体积的变化
溶液,pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如下图所示,下列说法不正确的是
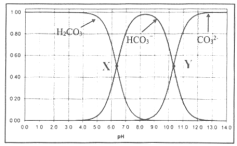
A.人体血液的![]() ,其中含碳微粒以
,其中含碳微粒以![]() 、
、![]() 为主
为主
B.除去NaCl溶液中![]() 的方法是向其中加入盐酸至
的方法是向其中加入盐酸至![]()
C.![]() 的溶液中
的溶液中![]()
![]()
D.将![]() 通入NaOH溶液制取
通入NaOH溶液制取![]() ,应大约控制
,应大约控制![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com