
【题目】如图是NO2气体和CO气体反应生成CO2 气体和NO气体过程的能量变化示意图。则该反应的热化学方程式为( )
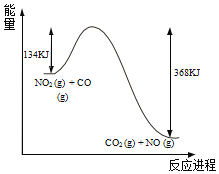
A.NO2+CO→CO2+NO-134kJ
B.NO2(g)+CO(g)→CO2(g)+NO(g)-234kJ
C.NO2(g)+CO(g)CO2(g)+NO(g)+368kJ
D.NO2(g)+CO(g)CO2(g)+NO(g)+234kJ
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】有关下列电化学装置的说法中正确的是

A.图a是原电池装置,可以实现化学能转化为电能
B.图b电解一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有溶质的物质的量浓度均为![]() 的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④(NH4)2SO4 ⑤KOH ⑥NaF⑦ KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是()
的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④(NH4)2SO4 ⑤KOH ⑥NaF⑦ KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是()
A.②①③④⑧⑦⑥⑤
B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤
D.②①⑧③⑥④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
![]() 已知:
已知:![]() 、
、![]() 分子中化学键的键能分别是
分子中化学键的键能分别是![]() 、
、![]()
![]()
![]()
则相同条件下破坏1molNO中化学键需要吸收的能量为______kJ。
![]() 如图所示,U形管内盛有100mL的溶液,
如图所示,U形管内盛有100mL的溶液,
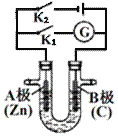
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为
,若所盛溶液为![]() 溶液:则A为______极。若所盛溶液为KCl溶液:
溶液:则A为______极。若所盛溶液为KCl溶液:![]() 移向______极
移向______极![]() 填“A”、“B”
填“A”、“B”![]()
![]() 断开
断开![]() ,闭合
,闭合![]() ,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开
,若所盛溶液为滴有酚酞的NaCl溶液,则:A电极附近可观察到的现象是______。反应一段时间后打开![]() ,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
,若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
![]() 若是电解精炼粗铜,断开
若是电解精炼粗铜,断开![]() ,闭合
,闭合![]() ,电解液选用
,电解液选用![]() 溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中
溶液,则A电极的材料应换成______,反应一段时间后电解质溶液中![]() 浓度______
浓度______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐可能含有 K+、IO3-、I-、Mg2+.加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热引起的。
已知:IO3-+5I-+6H+→3I2+3H2O,2Fe3++2I-→2Fe2++I2,KI+I2KI3;氧化性: IO3->Fe3+>I2。
(1)学生甲对某加碘盐进行如下实验,以确定该加碘盐中碘元素的存在形式。取一定量加碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为 3 份。第一份试液中滴加 KSCN 溶液后显红色;第二份试液中加足量 KI 固体,溶液显淡黄色,加入 CCl4,下层溶液显紫红色;第三份试液中加入适量 KIO3 固体后,滴加淀粉试剂,溶液不变色。
①第一份试液中,加 KSCN 溶液显红色,该红色物质是______(用化学式表示)。
②第二份试液中“加入 CCl4”的实验操作名称为______,CCl4 中显紫红色的物质是______(用化学式表示)。
③根据这三次实验,学生甲得出以下结论:
在加碘盐中,除了 Na+、Cl-以外,一定存在的离子是______,可能存在的离子是______,一定不存在的离子是______。由此可确定,该加碘盐中碘元素是______价(填化合价)的碘。
(2)将 I2溶于 KI 溶液,在低温条件下,可制得 KI3H2O.该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由______。
(3)已知:I2+2S2O32-→2I-+S4O62-.学生乙用上述反应方程式测定食用精制盐的碘含量(假设不含Fe3+),其步骤为:
a.准确称取 wg 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量 KI 溶液,使 KIO3与 KI 反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为 2.0×10-3mol/L 的 Na2S2O3 溶液 10.0mL,恰好反应完全。
根据以上实验,学生乙所测精制盐的碘含量(以 I 元素计)是______mg/kg(以含w的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2,搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
(1)①中加热并搅拌的目的是_____________________________。
(2)②中发生反应的离子方程式是_________________________。
(3)③中的物质A可能是__________________;调整的PH范围是_______________;
过滤后滤渣的成分是__________________。
(4)③中发生反应的离子方程式是_________________________。
(5)①③中如何用pH试纸测定溶液的pH值:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
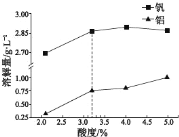
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com