
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
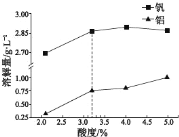
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)
【答案】CaO+O2+V2O3![]() Ca(VO3)2 Ca(VO3)2+4H+=2
Ca(VO3)2 Ca(VO3)2+4H+=2![]() +Ca2++2H2O 酸度大于3.2%时,钒的溶解量增大不明显,而铝的溶解量增大程度更大 调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀 当pH>8时,钒的主要存在形式不是
+Ca2++2H2O 酸度大于3.2%时,钒的溶解量增大不明显,而铝的溶解量增大程度更大 调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀 当pH>8时,钒的主要存在形式不是![]()
![]()
【解析】
向石煤中加生石灰焙烧,发生主要反应:CaO+O2+V2O3![]() Ca(VO3)2,加酸酸浸,将浸出液用石灰乳得到Ca3(VO4)2沉淀富集钒元素,向沉淀加入(NH4)2CO3溶液得到(NH4)3VO4溶液,向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5,得到NH4VO3,煅烧制得V2O5,
Ca(VO3)2,加酸酸浸,将浸出液用石灰乳得到Ca3(VO4)2沉淀富集钒元素,向沉淀加入(NH4)2CO3溶液得到(NH4)3VO4溶液,向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5,得到NH4VO3,煅烧制得V2O5,
(1)V2O3与CaO、氧气焙烧得到Ca(VO3)2,据此书写;
(2)①根据题意,pH=4,Ca(VO3)2溶于盐酸生成![]() ,据此书写;
,据此书写;
②根据酸度对钒和铝的溶解量的图可知,酸度超过3.2%,钒的溶解量变化不大;
(3)①石灰乳的作用是得到Ca3(VO4)2沉淀富集钒元素;
②根据图表可知当pH>8时,钒的主要存在形式发生改变;
(4)加入高锰酸钾发生反应:![]() ,根据消耗高锰酸钾的量计算剩余的Fe2+物质的量,再结合消耗的(NH4)2Fe(SO4)2计算
,根据消耗高锰酸钾的量计算剩余的Fe2+物质的量,再结合消耗的(NH4)2Fe(SO4)2计算![]() 反应Fe2+物质的量,结合关系式:
反应Fe2+物质的量,结合关系式:![]() 计算。
计算。
(1)焙烧过程将V2O3转化为Ca(VO3)2,CaO参与反应,V元素化合价升高,需要氧气参加反应,反应方程式为:CaO+O2+V2O3![]() Ca(VO3)2,
Ca(VO3)2,
故答案为:CaO+O2+V2O3![]() Ca(VO3)2;
Ca(VO3)2;
(2)①Ca(VO3)2难溶于水,可溶于盐酸,若焙砂酸浸时溶液的pH=4,由表中数据可知,Ca(VO3)2溶于盐酸转化为![]() ,反应离子方程式为:Ca(VO3)2+4H+=2
,反应离子方程式为:Ca(VO3)2+4H+=2![]() +Ca2++2H2O,
+Ca2++2H2O,
故答案为:Ca(VO3)2+4H+=2![]() +Ca2++2H2O;
+Ca2++2H2O;
②根据如图推测,酸浸时不选择更高酸度的原因是:酸度大于span>3.2%时,钒的溶解量增大不明显,而铝的溶解量增大程度更大,
故答案为:酸度大于3.2%时,钒的溶解量增大不明显,而铝的溶解量增大程度更大;
(3)焙烧过程将V2O3转化为Ca(VO3)2,用盐酸酸浸,浸出液中含有![]() 、Al3+、Ca2+、Cl、H+,加入石灰乳调节pH得到Ca3(VO4)2沉淀,由表中数据,可知应控制pH范围为1012,由Ca(VO3)2→Ca3(VO4)2,可知氢氧化钙还提供Ca2+,过滤分离,Ca3(VO4)2与碳酸铵反应转化为更难溶的CaCO3沉淀,c(Ca2+)降低,使钒从沉淀中转移到溶液中形成(NH4)3VO4溶液,溶液中加入NH4Cl,调节溶液pH,同时溶液中
、Al3+、Ca2+、Cl、H+,加入石灰乳调节pH得到Ca3(VO4)2沉淀,由表中数据,可知应控制pH范围为1012,由Ca(VO3)2→Ca3(VO4)2,可知氢氧化钙还提供Ca2+,过滤分离,Ca3(VO4)2与碳酸铵反应转化为更难溶的CaCO3沉淀,c(Ca2+)降低,使钒从沉淀中转移到溶液中形成(NH4)3VO4溶液,溶液中加入NH4Cl,调节溶液pH,同时溶液中![]() 增大,有利于析出(NH4)3VO3,
增大,有利于析出(NH4)3VO3,
①浸出液中加入石灰乳的作用是:调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀,
故答案为:调节溶液的pH,并提供Ca2+,形成Ca3(VO4)2沉淀;
②当pH>8时,钒的主要存在形式不是![]() ,NH4VO3的产量明显降低,
,NH4VO3的产量明显降低,
故答案为:当pH>8时,钒的主要存在形式不是![]() ;
;
(4)加入高锰酸钾发生反应:![]() ,反应消耗KMnO4为b2×103L×c2molL1=b2c2×103mol,剩余的Fe2+物质的量=5b2c2×103mol,与
,反应消耗KMnO4为b2×103L×c2molL1=b2c2×103mol,剩余的Fe2+物质的量=5b2c2×103mol,与![]() 反应Fe2+物质的量=b1×103L×c1molL15b2c2×103mol=(b1c15b2c2)×103mol,由关系式
反应Fe2+物质的量=b1×103L×c1molL15b2c2×103mol=(b1c15b2c2)×103mol,由关系式![]() 可知n(V2O5)=
可知n(V2O5)=![]() mol,故产品中V2O5的质量分数为:
mol,故产品中V2O5的质量分数为: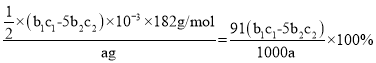 ,
,
故答案为:![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
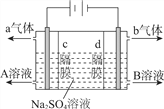
A.a气体为氢气,b气体为氧气
B.A为氢氧化钠溶液,B为硫酸溶液
C.通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D.该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NO2气体和CO气体反应生成CO2 气体和NO气体过程的能量变化示意图。则该反应的热化学方程式为( )
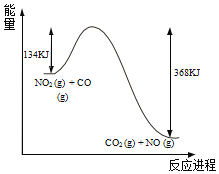
A.NO2+CO→CO2+NO-134kJ
B.NO2(g)+CO(g)→CO2(g)+NO(g)-234kJ
C.NO2(g)+CO(g)CO2(g)+NO(g)+368kJ
D.NO2(g)+CO(g)CO2(g)+NO(g)+234kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K 是称为 PTT 的高分子材料,因具有优良的性能而可作工程塑料、纺织纤维等有广泛的应用。如图所示是 PTT 的一种合成路线。
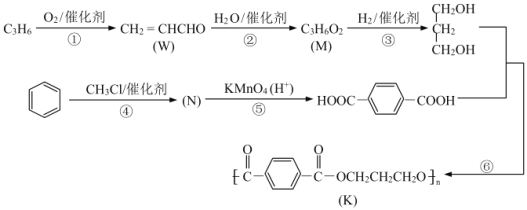
已知:
完成下列填空:
(1)W 所含官能团的名称为______。反应③的化学反应类型为______。
(2)M 的结构简式为______,反应④的化学反应方程式为______。
(3)反应⑥的另一无机产物是______,与反应⑥的化学反应类型无关的是(选填编号)______。
A.聚合反应B.酯化反应C.消去反应D.加成反应
(4)有机物X 的分子式为 C4H8O2,是 M 的同系物。则 X 可能的结构简式共有______种。
(5)设计一条由甲苯为原料(无机试剂可任选)合成苯甲酸苯甲酯的合成路线。(合成路线常用表示方式为 A![]() B ……
B ……![]() 目标产物)_____________
目标产物)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严重。将燃料电池引入 硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能 以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。下列说法不正确的是( )
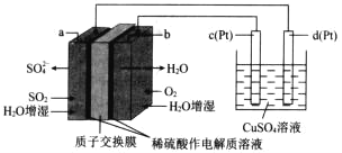
A.若 a 极消耗 2.24LSO2,理论上 c 极有 6.4g 铜析出
B.H+由 a 极通过质子交换膜向 b 极移动
C.该燃料电池的总反应式为 2SO2+O2+2H2O=2H2SO4
D.b 极为正极,电极反应式为 O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 水玻璃中通入过量的二氧化碳: Na2SiO3+CO2+H2O===2Na++CO![]() +H2SiO3
+H2SiO3
B. 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO![]()
C. 二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2O
D. 二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com