
【题目】用中和滴定法测定某烧碱样品(含有氯化钠的杂质)的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________称量。配制溶液选用________(填编号字母)
A.小烧杯中 B.洁净纸片上
C.500 mL容量瓶 D.500 mL试剂瓶
(2)为了避免测定过程中样品部分与空气中二氧化碳反应导致结果偏差,滴定时,用0.2000 mol/L的盐酸标准液来滴定待测溶液,可选用________(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视_____________,若用酚酞做指示剂,滴定终点的标志是____________,滴定结果是________(偏大,偏小,不变),理由______________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是____________。
滴定次数 | 待测溶液体积 (mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
【答案】A D A 锥形瓶中液体颜色变化 溶液由红色变为浅红色,且半分钟内不褪色 偏小 滴定终点时,溶液中碳酸离子被滴定为碳酸氢根离子,消耗盐酸较少 0.4000 97.56%
【解析】
(1)氢氧化钠易潮解,易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量,防止玷污托盘;配成500 mL待测溶液,应该盛放在500 mL的试剂瓶中,故答案为:A;D;
(2)为了避免测定过程中样品部分与空气中二氧化碳反应导致结果偏差,滴定时,用0.2000 mol/L的盐酸标准液来滴定待测溶液,酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂,如果选择酚酞,则氢氧化钠的浓度会受到二氧化碳的影响,因此只能选择甲基橙,故选A;
(3)滴定过程中两眼应该注视锥形瓶内溶液的颜色变化;若用酚酞做指示剂,滴定终点的现象为溶液由红色变为浅红色,且半分钟内不褪色,滴定终点时,溶液中碳酸根离子被滴定为碳酸氢根离子,消耗盐酸较少,导致氢氧化钠溶液的浓度偏小,故答案为:锥形瓶内溶液的颜色变化;溶液由红色变为浅红色,且半分钟内不褪色;偏小;滴定终点时,溶液中碳酸离子被滴定为碳酸氢根离子,消耗盐酸较少;
(4)两次实验消耗标准液体积分别为:20.50 mL -0.40 mL =20.10mL,24.00 mL -4.10 mL =19.90mL,则2次消耗标准液的平均体积为:20.00mL,氢氧化钠的物质的量浓度为:![]() =0.4000mol/L,原样品中含有氢氧化钠的质量为:0.4000mol/L×0.5L×40g/mol=8g,则样品的纯度为:
=0.4000mol/L,原样品中含有氢氧化钠的质量为:0.4000mol/L×0.5L×40g/mol=8g,则样品的纯度为:![]() ×100%=97.56%,故答案为:0.4000;97.56%。
×100%=97.56%,故答案为:0.4000;97.56%。


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
【题目】盐酸或硫酸和NaOH溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明NaOH溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题:
(1)方案一:如图装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内NaOH溶液混合,此时观察到的现象是________________________________,原因是__________________________________________________。

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果NaOH溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的NaOH溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:

则x=______。假设盐酸和NaOH溶液的密度都是1 g·cm-3,又知中和后生成溶液的比热容c=4.18 J·g-1·℃-1,依据该小组的实验数据计算,写出表示稀盐酸和稀NaOH溶液反应的中和热的热化学方程式________________________________________。
(3)若H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1;现有:①稀H2SO4与Ba(OH)2(aq) ②浓H2SO4与Ba(OH)2(aq) ③稀HNO3与Ba(OH)2(aq)反应生成1 mol H2O(l)的反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3三者由小到大的关系为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 HO—CH2CH==CHCH2—COOH,该有机物不可能发生的化学反应是( )
A. 水解B. 氧化C. 酯化D. 加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。

(1)沉淀A的主要成分是___、___(填化学式)。
(2)③中加入过量的Na2CO3溶液的目的是___。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是___,为了除去杂质,可向溶液3中加入适量的____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压下,1 mol A 和 n mol B 在一个容积可变的容器中发生如下可逆反应:A(g) + 2B(g)2C(g),一段时间后达到平衡,生成 a mol C,则下列说法中正确的是 ( )
A. 物质 A、B 的转化率之比为 1∶2
B. 起始时刻和达到平衡后容器中混合气体的密度相等
C. 当υ正(A) = 2υ逆(C)时,可断定反应达到平衡状态
D. 若起始时放入 2 mol A 和 2n mol B,则达平衡时 C 的物质的量为 2a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol氢气和氧气完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是
A. 2H2(g)+O2(g)→2H2O(g)+241.8kJ
B. H2(g)+1/2O2(g)→H2O(s)+241.8 kJ
C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJ
D. H2O(g)→H2(g)+1/2O2(g)-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是
A. 研究菠菜蛋白质“发电”不属于“太阳能文明”
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能转化为电能
D. 石油和天然气都属于碳素燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下
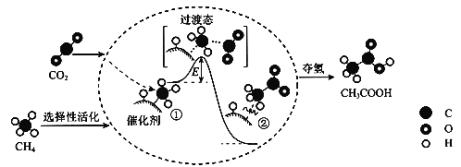
下列说法正确的是
A. 生成CH3COOH总反应的原子利用率小于100%
B. CH4+CO2→CH3COOH过程中,CH4分子中所有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效改变该反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com