
【题目】FeCl3溶液可以蚀刻印刷电路板上的Cu。某实验兴趣小组模拟该过程,并回收Cu和蚀刻液的流程如下:
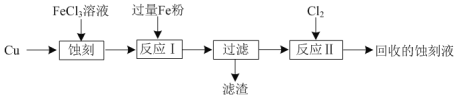
(1)“蚀刻”时的化学反应方程式为____。
(2) 滤渣的成分为____。
(3)“反应Ⅱ”的离子方程式为____。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
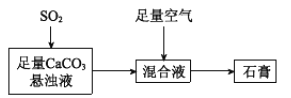
【题目】钢铁厂的副产品SO2多用于制硫酸和石膏等。
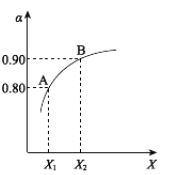
(1)制硫酸最重要的反应是:![]() 。如图表示将2.0molSO2和一定量的O2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,则X(X1、X2)可以代表的物理量是________。
。如图表示将2.0molSO2和一定量的O2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,则X(X1、X2)可以代表的物理量是________。
(2)下图表示生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO2发生反应的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。
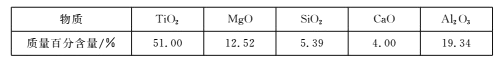
通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。
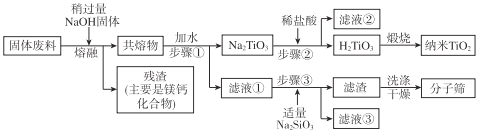
请回答下列问题:
(1)步骤①②③中所用的玻璃仪器___。
(2)下列固体废料的成分中,不属于碱性氧化物的是___(填字母序号)。
a.TiO2 b.SiO2 c.MgO d.CaO
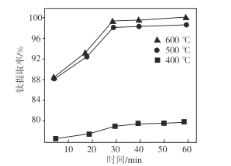
(3)熔融温度和钛的提取率关系如图,适宜温度为500℃,理由是___。
(4)滤液①中溶质的主要成分是___。
(5)步骤②中发生反应的离子方程式是___。
(6)将步骤③中制取分子筛的化学方程式补充完整:
![]() ___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+
___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+![]() ___
___
根据成分表中数据,计算100kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=___mol(摩尔质量/g/mol:SiO2-60,Al2O3-102)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A.0~5min内,v (H2)=0.05mol/(Lmin)
B.5min时该反应的K值一定小于12 min时的K值
C.10 min时,改变的外界条件可能是减小压强
D.5min时该反应的v (正)大于11 min 时的v (逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
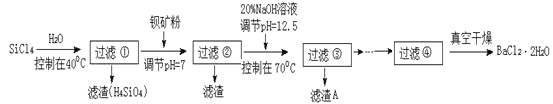
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-
B.pH=1的溶液中:Fe2+、NO3-、SO42-
C.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、Cl-、HCO3-
D.c (Fe3+)=0.1mol/L的溶液中:K+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和某铁的氧化物(xFeO·yFe2O3)粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为
A.1∶1B.1∶2C.5∶7D.7∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 1 mol Zn与足量该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( )
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=1048.9 kJ·mol-1
A. ΔH4﹦2ΔH32ΔH2ΔH1
B. O2(g)+2H2(g)![]() 2H2O(l) ΔH5,ΔH5>ΔH3
2H2O(l) ΔH5,ΔH5>ΔH3
C. 1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)
D. 联氨和N2O4作火箭推进剂的原因之一是反应放出大量的热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com